研究背景
乳腺癌干细胞(BCSCs)具有自我更新和长期保持乳腺肿瘤能力,是乳腺肿瘤发生、转移和耐药性的根源。铁死亡是一种细胞死亡的非凋亡性形式,由铁依赖的脂质过氧化作用驱动,并与氧化还原平衡的扰动有关。CSCs对铁死亡非常敏感,然而BCSCs中铁死亡的信号调控机制尚不清楚。NRF2作为氧化还原动态平衡的主要转录调节因子,能够促进肿瘤的进展、转移和对治疗的抵抗,对于NRF2转录活性的表观遗传调控研究较少。
ZMYND,一种组蛋白表观遗传修饰“阅读器”,可识别组蛋白H4的乙酰赖氨酸16(H4K16ac),与HIF-1/2α、BRD4和P-TEFb复合体协同激活下游基因。最新研究表明ZMYND8在维持BCSCs和引发乳腺肿瘤中发挥重要作用。基于上述,本研究中进一步揭示了ZMYND8通过激活NRF2保护乳腺癌干细胞抗氧化应激和铁死亡的影响。
文献来源
美国得克萨斯大学西南医学中心罗伟波团队在Journal of Clinical Investigation上发表题为ZMYND8 protects breast cancer stem cells against oxidative stress and ferroptosis through activation of NRF2的研究论文。
研究发现ZMYND8在体外和体内均可以减轻BCSCs的氧化应激和铁死亡,从而促进肿瘤的发生。机制上ZMYND8增加了NRF2蛋白的稳定性,并与NRF2物理结合,增强了BCSCs中NRF2依赖的抗氧化基因的表达。
项目研究
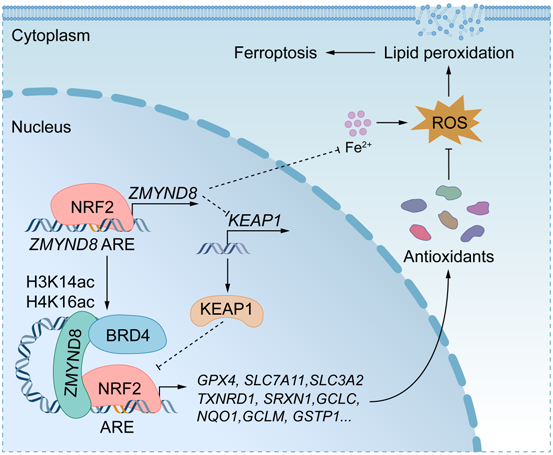
ZMYND8诱导的抗氧化防御机制保护BCSCs抗铁死亡的模型如下:
一方面,ZMYND8通过抑制KEAP1的表达而促进NRF2蛋白的稳定性;
另一方面,ZMYND8通过PBP结构域与NRF2的Neh1结构域直接相互作用将NRF2招募至细胞抗氧化基因的启动子区以增强NRF2的转录因子活性。而NRF2反过来又可以通过ZMYND8启动子区的抗氧化反应元件增加ZMYND8的转录。
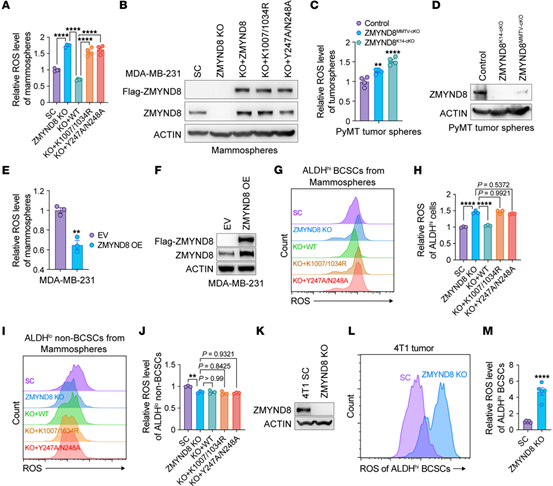
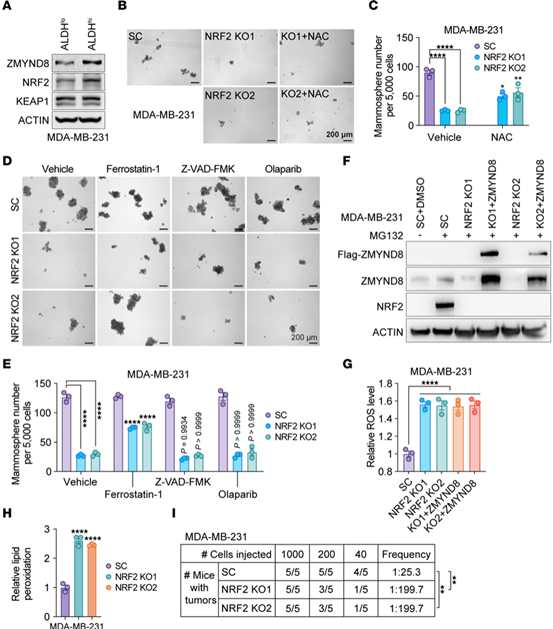
作者使用ROS探针检测了细胞中ROS水平,发现ZMYND8 KO MDA-MB-231乳腺球中ROS显著增加,过表达则降低了ROS水平。随后,研究人员用流式细胞术检测了ALDH高表达(ALDHhi)BCSCs的ROS水平,发现ZMYND可以降低ALDHhi BCSCs中的ROS,而且从敲除ZMYND8的4T1细胞同种异体移植瘤中分离的ALDHhi BCSCs中ROS水平也出现增加。这些结果表明,ZMYND8是ALDHhi BCSCs中ROS的负调控因子。
Fig.1 ZMYND8降低ALDHhi BCSCs的氧化应激
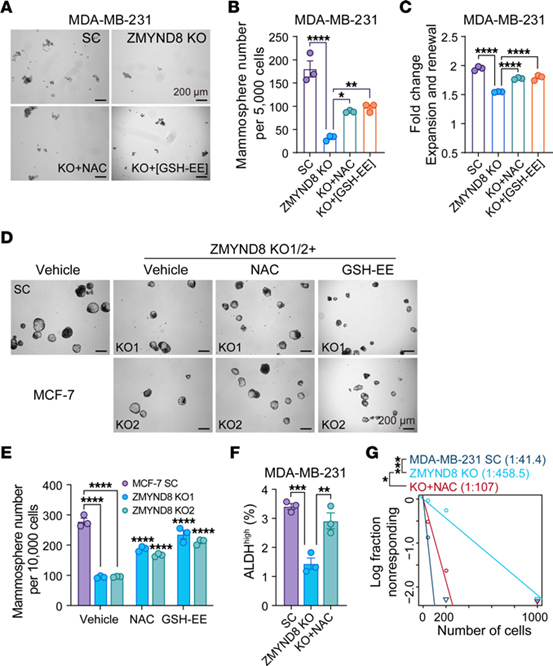
ZMYND8 KO抑制了MDA-MB-231乳腺球的形成和自我更新,而抗氧化剂(NAC和GSH-EE)部分阻止了ZMYND8 KO导致的BCSC干性丧失。
接下来,研究人员将ZMYND8 KO MDA-MB-231细胞原位接种于雌性小鼠乳房脂肪垫内,给予NAC组显著恢复了小鼠ZMYND8-KO肿瘤的发生率。综上所述,ZMYND8在体外和体内通过降低ROS来维持ALDHhi BCSCs的干性。
Fig.2 ZMYND8通过减少ROS促进ALDHhi BCSCs干性维持
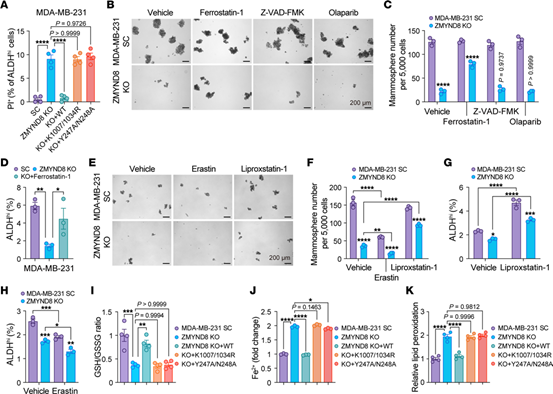
使用铁死亡抑制剂、细胞凋亡抑制因子和PAR1依赖性细胞死亡抑制剂处理ZMYND8 KO MDA-MB-231细胞,铁死亡抑制剂部分阻止了ZMYND8 KO导致的MDA-MB-231乳腺球和ALDHhi BCSCs的丢失。
随后研究人员测定了细胞中铁死亡相关的指标,发现ZMYND8 KO显著增加了Fe2+水平,并诱导了脂质过氧化。上述结果表明,ZMYND8通过抑制铁死亡维持ALDHhi BCSCs的干性。
Fig.3 ZMYND8可抑制ALDHhi BCSCs的铁死亡
与ZMYND8一致,NRF2也在ALDHhi BCSCs中上调,NRF2 KO显著减少了MDA-MB-231乳腺球的形成,增加ROS和脂质过氧化。同样,Ferrostatin-1也能部分挽救NRF2 KO导致的乳腺球减少。限制稀释试验结果表明,NRF2 KO抑制了NSG小鼠体内肿瘤的发生。研究人员敲除了ZMYND8-OE-MDA MB-231细胞中的NRF2,结果表明NRF2 KO可以抑制ZMYND8过表达对ROS水平的调节。综上所述,ZMYND8依赖于NRF2以清除BCSCs中的ROS。
Fig.4 ZMYND8依赖于NRF2以抑制铁死亡
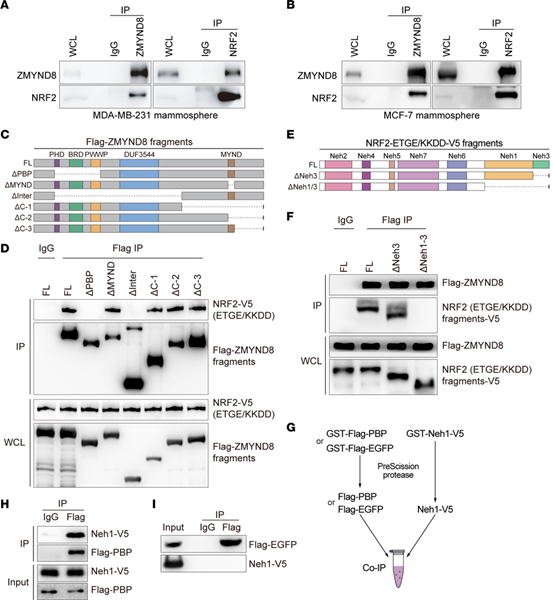
为了研究ZMYND8在BCSCs细胞中增强NRF2活化的机制。首先评估ZMYND8是否与NRF2相互作用。Co-IP结果证明了NRF2与ZMYND8存在相互作用。
通过构建ZMYND8截短体质粒,证明了ZMYND8通过PBP结构域与NRF2相互作用。同理,验证可得NRF2的Neh1结构域是与ZMYND8相互作用所必需的。GST-pulldown结果表明,ZMYND8的PBP结构域与NRF2的Neh1结构域直接相互作用。
Fig.5 ZMYND8与NRF2直接相互作用
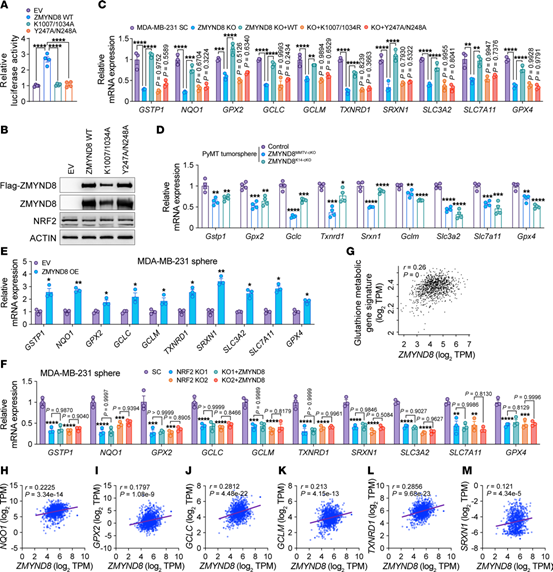
荧光素酶报告基因实验表明,ZMYND8过表达明显增加了NRF2的转录活性,ZMYND8 KO在体内和体外均显著降低了NRF2下游抗氧化基因的表达,说明ZMYND8增强了依赖于NRF2的抗氧化基因的转录。
人类乳腺肿瘤基因相关性分析表明,ZMYND8 mRNA与乳腺肿瘤中谷胱甘肽代谢的基因及抗氧化基因呈正相关。综上所述,ZMYND8增强了NRF2的转录活性,从而导致BCSCs中抗氧化基因的转录。
Fig.6 ZMYND8可增强NRF2的转录活性
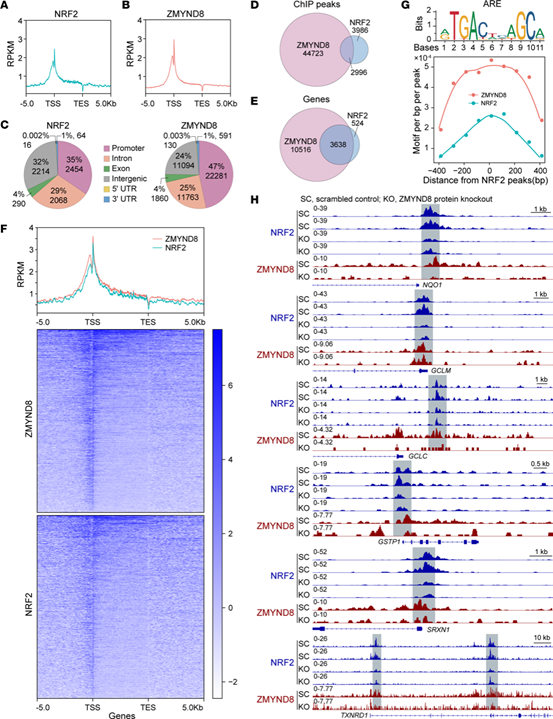
为确定ZMYND8是否协同激活NRF2下游的抗氧化基因,进行了ChIP Seq分析。对照组中,ZMYND8和NRF2在转录起始位点附近高度富集,且二者ChIP-Seq峰出现重叠。对ZMYND8 ChIP-Seq峰的基序分析表明,ARE基序明显富集。ZMYND8 KO显著降低了NRF2和ZMYND8在NRF2下游的抗氧化基因上的富集。这些结果表明,ZMYND8将NRF2招募到抗氧化基因的AREs上,从而介导BCSCs中的基因转录。
Fig.7 ZMYND8将NRF2招募至抗氧化基因的启动子
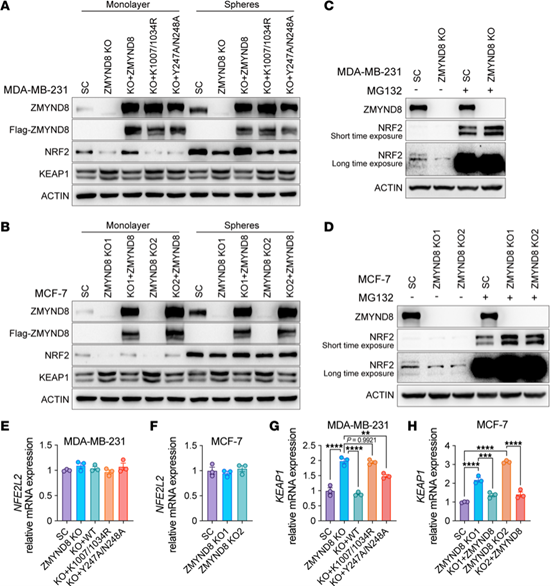
ZMYND8 KO降低了MDA-MB-231中的NRF2蛋白水平,而MG132可以阻止ZMYND8 KO 导致的NRF2蛋白减少,这表明ZMYND8增加了乳腺癌细胞中NRF2蛋白的稳定性。研究发现,ZMYND8 KO诱导KEAP1蛋白表达,在mRNA水平也观察到ZMYND8对KEAP1的负调控作用。上述结果表明,ZMYND8通过其表观遗传活性抑制了KEAP1的转录,提升了NRF2蛋白的稳定性。
Fig.8 ZMYND8通过抑制KEAP1增加NRF2蛋白的稳定性
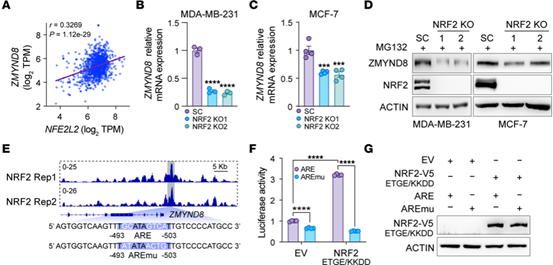
研究人员发现,ZMYND8和NFE2L2的mRNA水平在多种癌症中呈正相关,NRF2 KO乳腺癌细胞中ZMYND8的mRNA和蛋白水平均有降低。这说明NRF2是ZMYND8的上游调节因子。
ChIP-Seq结果表明,在ZMYND8启动子处有强大的NRF2结合峰,并且NRF2结合区内存在一个假定的ARE。报告基因实验结果表明,NRF2 过表达显著提高了ZMYND8 ARE报告活性。这些结果说明,NRF2通过结合ZMYND8启动子上的ARE激活ZMYND8的转录。
Fig.9 ZMYND8是NRF2的直接靶基因
研究结论
综上所述,ZMYND8和NRF2在ALDHhi BCSCs中被诱导,并共同作用抑制BCSCs的铁死亡,诱导小鼠乳腺肿瘤的发生。ZMYND8是NRF2的直接靶基因,并通过正反馈机制,放大NRF2的活化功能,保护ALDHhi BCSCs免受氧化应激和铁死亡的影响。
吉满生物
如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
原文链接:https://pubmed.ncbi.nlm.nih.gov/38488001/