文献解读
《Molecular Cancer》期刊上发表了一篇题为“Single-cell multi-omics reveals that FABP1 + renal cell carcinoma drive tumor angiogenesis through the PLG-PLAT axis under fatty acid reprogramming”的研究论文。
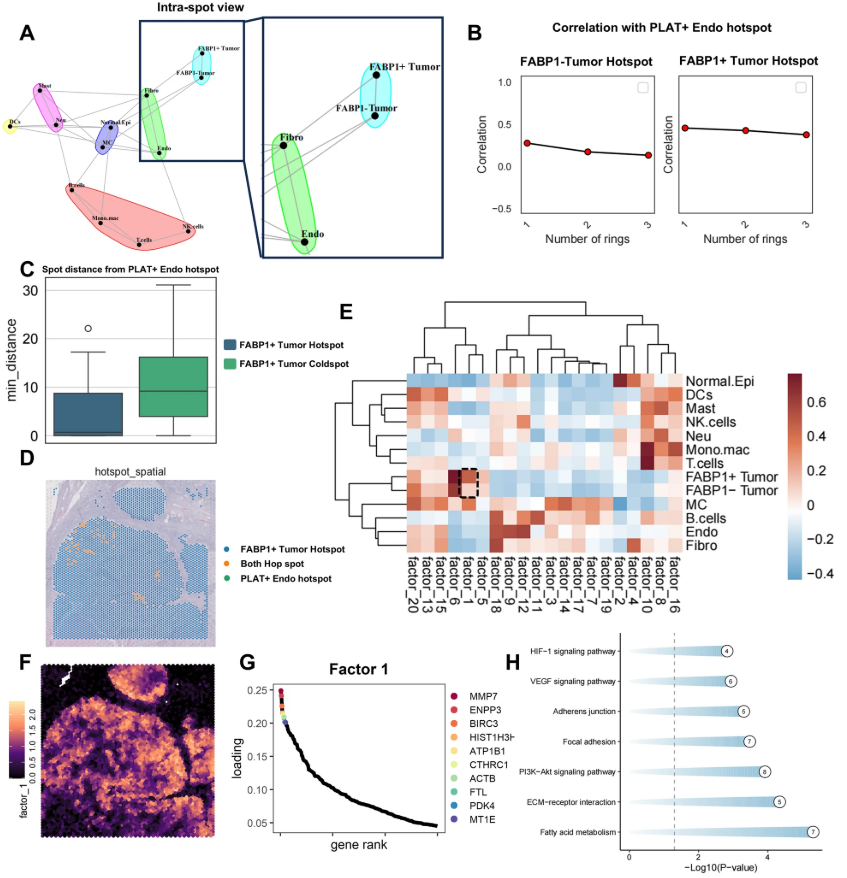
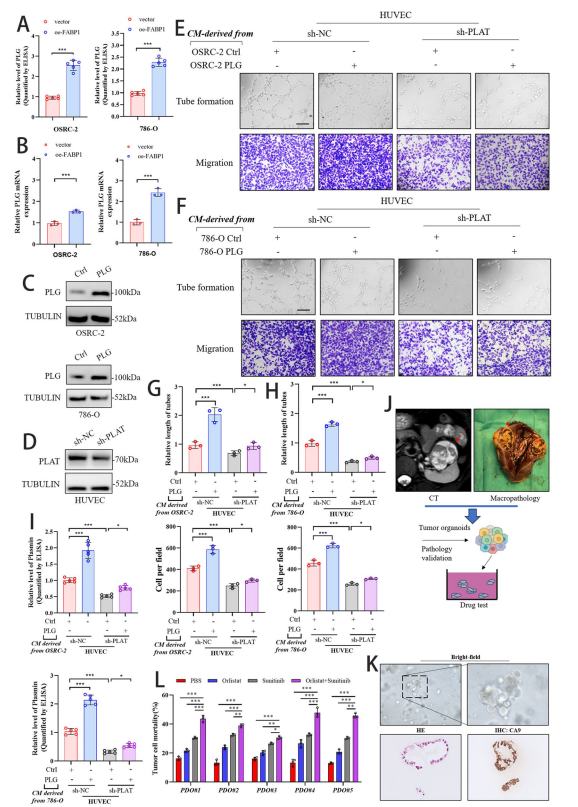
作者基于单细胞多组学提出:在脂肪酸重编程背景下,出现一类高表达脂肪酸结合蛋白1(FABP1)的肿瘤细胞亚群,可能通过与内皮细胞的配体–受体互作促进血管新生。 纤溶系统中的纤溶酶原(PLG)及其激活因子 PLAT 被怀疑为关键轴,或为 VEGF 之外的可成药靶点。研究旨在解析“FABP1+ 肿瘤细胞—PLG–PLAT—内皮”的跨细胞通路及其致病与转化意义。 研究背景 肾细胞癌(RCC)高度血管化,血管生成是肿瘤生长与转移的关键驱动力。尽管抗 VEGF/VEGFR 治疗取得一定疗效,但耐受与复发常见,提示存在替代性促血管机制。 代谢重编程,尤其脂肪酸代谢改变,是RCC的分子特征之一,然而“脂代如何具体促发血管生成”的通路尚未阐明。单细胞技术为解析肿瘤异质性与细胞间通讯提供了手段。 项目研究 研究者通过对34例肾细胞癌(RCC)及癌旁正常组织(NAT)的120、183个单细胞进行scRNA-seq分析,发现FABP1高表达的C2亚群,该亚群恶性CNV显著且伴随脂肪酸代谢重编程,预示预后不良。 功能层面,FABP1⁺肿瘤富集VEGF、迁移-血管生成通路,分化程度低。细胞通讯与空间转录组进一步揭示,FABP1⁺肿瘤通过ETV2调控的PLG-PLAT轴与PLAT⁺内皮细胞紧密共定位,而空间NMF证实其热点与PLAT⁺内皮细胞距离更近,且专属Factor1高表达MMP7/ENPP3并富集脂肪酸代谢与ECM-VEGF通路,从单细胞到空间层面完整勾勒出FABP1⁺肿瘤驱动血管生成的微环境网络。 Fig.1 FABP1 + 肿瘤与内皮细胞之间的空间关系,以及 FABP1 + 肿瘤的 NMF 因子 研究团队通过临床样本、细胞实验及小鼠原位模型证实,FABP1在转移性RCC中高表达。在786-O和OSRC-2细胞中稳定过表达FABP1后,甘油三酯含量显著升高,并增强HUVEC的管形成与迁移能力。 将luciferase-OSRC-2细胞(oe-FABP1或对照)注入裸鼠左肾包膜下,FABP1过表达组肿瘤生长加快、脂质沉积增加,并出现更多远处转移灶。给予抗血管生成药物Rh-Endostatin可显著抑制FABP1过表达诱导的肿瘤生长和转移,并通过CD34/PAS染色证实其阻断血管生成的作用。而抗血管生成药物Rh-Endostatin可逆转上述效应,FABP1通过促进脂质积累和肿瘤相关血管生成,加速RCC进展与转移,抑制血管生成可逆转这一效应。 Fig.2 FABP1在促进肿瘤血管生成中的作用 ELISA与qRT-PCR显示,FABP1过表达的OSRC-2和786-O细胞中,PLG蛋白分泌量及其mRNA水平均显著升高。 构建PLG过表达的RCC细胞系及PLAT敲低的HUVECs,以RCC条件培养基孵育HUVECs发现,PLG过表达显著增强HUVEC管形成与迁移。敲低PLAT或抑制PLAT活性可部分逆转上述促血管效应。 ELISA证实,PLAT敲低降低PLG诱导的纤溶酶生成。患者来源类器官(PDO)实验中,单药或联合处理24小时后,Orlistat(FABP1抑制剂)联合Sunitinib(TKI)的类器官死亡率显著高于单药,Bliss独立模型显示协同指数2.8,提示两药联用具有显著协同杀伤作用。 研究结论 本研究通过单细胞多组学结合空间转录组,首次鉴定出以FABP1高表达为标志的促转移性肾细胞癌亚群,揭示其通过“FABP1-脂肪酸重编程-PLG-PLAT-纤溶酶-ECM重塑”轴驱动肿瘤血管生成和转移。 PDO及小鼠模型证实靶向该轴可显著增强酪氨酸激酶抑制剂疗效,为晚期RCC提供了新的联合治疗策略。 吉满生物 如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288