实验干货
腺相关病毒(Adeno-associated viral, AAV)属微小病毒科(Parvovirus),为无包膜的单链线状DNA(ssDNA)病毒,于20世纪60年代中期被首次发现,最初被当作是腺病毒培养中的污染物。
由于只有在腺病毒或者疱疹病毒等辅助病毒协助下,宿主才能产生具有感染性的AAV,所以AAV被称作腺相关病毒[1]。
野生型腺相关病毒
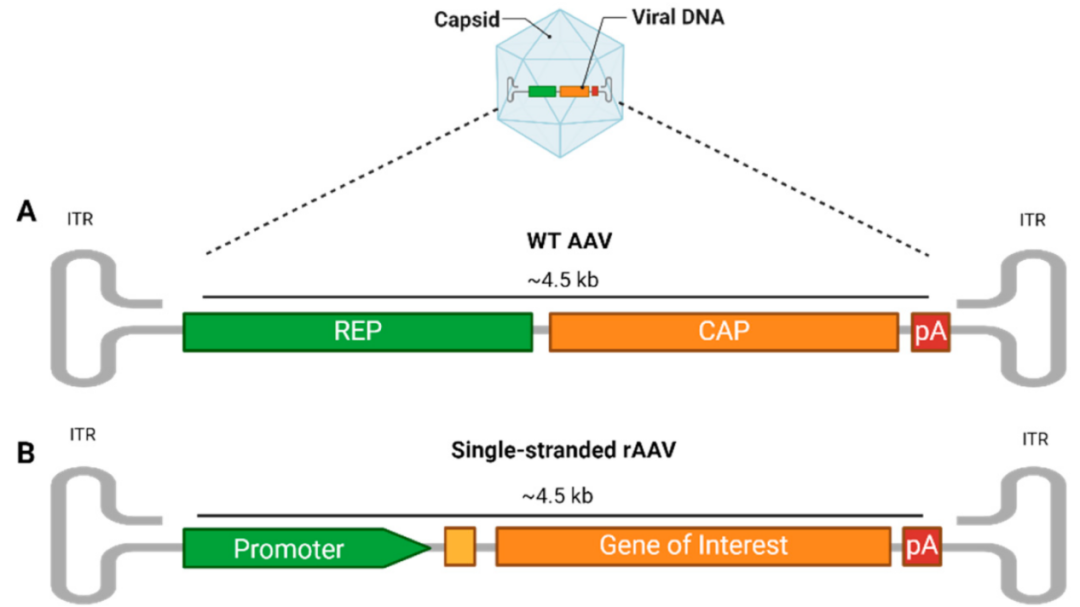
自然界中野生型腺相关病毒(wt AAV)为二十面体,全长约4.7 kb,包括2个反向末端重复序列(ITR)和两个主要读码框rep和cap,以及调控元件如聚腺苷酸化(PolyA)。
➡ITR
主要用作病毒复制起点和包装信号,对合成互补DNA链是必需的。
➡rep基因
编码病毒复制所需的四种蛋白质,它们按分子量命名为rep78、rep68、rep52和rep40
➡cap基因
通过可变剪接和翻译编码三种衣壳亚基VP1、VP2和VP3,总共60种拷贝,比例为1:1:10(VP1:VP2:VP3),进而决定衣壳的组成和结构[2][3] 。
这些衣壳蛋白对于病毒颗粒的稳定性和感染过程至关重要,因为它们通过其3D结构决定了与宿主细胞表面受体相互作用的特异性[4]。
图1 AAV结构[5]
A:野生型AAV
B:重组型AAV
天然AAV血清型
天然的AAV血清型源于其衣壳蛋白编码区的差异。这些衣壳蛋白的突变导致了不同血清型的出现,这些血清型可以通过血清学试验来鉴定。
值得注意的是,AAV2被认为是AAV家族的标准血清型,并作为研究其他AAV的有价值的参考,后续出现的许多AAV变体也是在AAV2骨架的基础上改造的。
AAV血清型与组织嗜性
每种AAV血清型的组织亲和力和转导效率存在差异,它们靶向不同的受体,并表现出独特的组织嗜性[6]。例如:
AAV1:具有较高的递送效率和广泛的组织特异性
AAV3:对于神经系统具有较高的递送效率
AAV5:对于肺部和肝脏等组织具有较高的递送效率
AAV7:在肌肉组织和肝脏中具有较高的递送效率,并且能够穿过血脑屏障递送到中枢神经系统
AAV9:对于全身性递送和神经系统组织具有较高的递送效率,是近年来研究较为活跃的AAV载体之一。
重组腺相关病毒
野生型AAV基因组可整合到人19号染色体长臂上的一个特定区域(19q13-qter),这个区域被称为AAVS1位点[3]。基于这个整合特性,科学家在2000年开展了改造AAV的工作,希望借此实现特定基因的靶向递送与调控。
重组腺相关病毒(rAAV)就是在保留野生型AAV的衣壳序列和结构的基础上,去除了所有AAV蛋白编码序列,替换为基因表达盒,从而改造成为特异性更强、安全性更高的基因载体[7] 。我们通常说的 AAV就是rAAV。
另外,由于其ssDNA基因组,常规AAV需要转录过程才能在细胞中产生双链DNA(dsDNA),从而导致基因表达延迟。为了提高基因表达的速度,自我互补AAV(scAAV)已经被设计成不需要DNA合成就可以折叠成dsDNA[8]。因此,与常规单链AAV(ssAAV)相比,scAAV通常表现出更高水平的基因表达,使其特别适合于需要快速和高转基因表达的研究。
但替换后的AAV并不能独立行使功能,还需要借助表达rep-cap的RC辅助质粒与表达腺病毒基因(E2、E2A等)的Helper辅助质粒,三者共转入HEK293T细胞进行病毒包装,才能产生含目的基因的活性AAV。这种三质粒包装系统是体外生产活性AAV颗粒的首选方法。
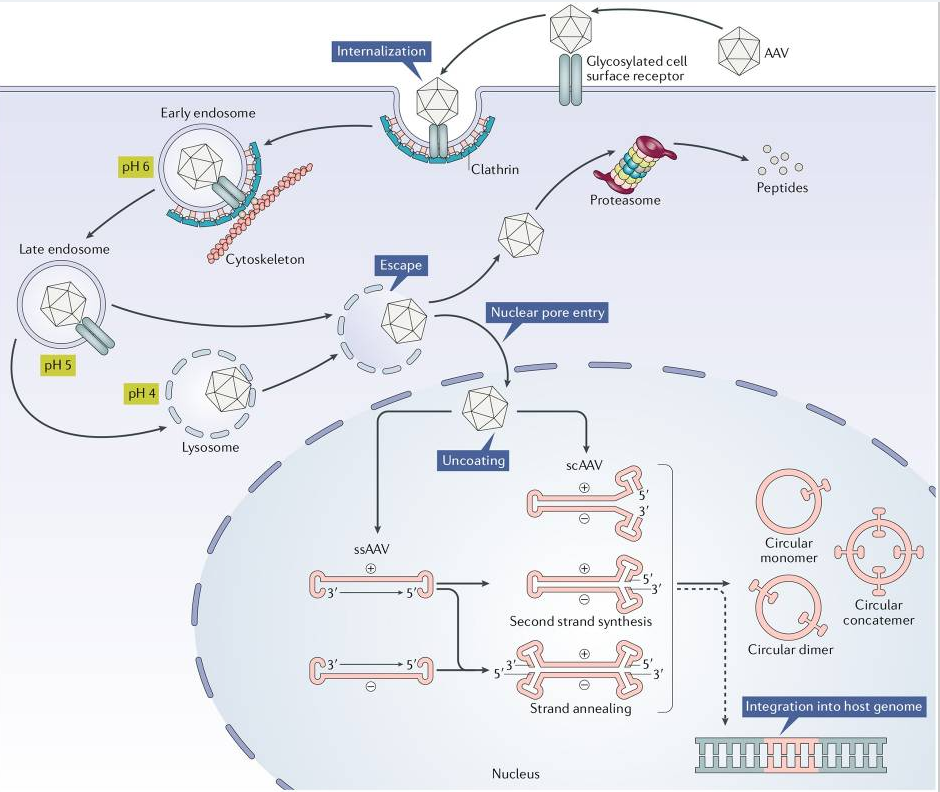
AAV作用机制
一、受体结合与内化:AAV 主要通过受体介导的内吞作用进入宿主细胞。不同血清型的AAV识别不同的受体,这决定了其组织嗜性(例如,AAV2型识别硫酸乙酰肝素蛋白聚糖)。这种结合触发病毒的内化,内化后形成的“内体”会将病毒包裹起来向细胞内部运输
二、核内体运输和逃逸:内体在运输过程中会逐渐酸化(pH值降低)。这种酸性环境会触发AAV衣壳蛋白(特别是VP1/VP2)发生构象变化,使其能够从内体中“逃逸”到细胞质中。逃逸后,病毒颗粒借助细胞的微管系统运输至细胞核附近
三、核进入,此步骤由核孔复合体促进
四、病毒脱壳:病毒颗粒可能在核内“脱壳”,将其单链DNA基因组释放到核内
五、转基因第二链的合成
六、载体持久性:这种双链 DNA 可以作为附加体存在于细胞核中,或者在野生型 AAV 的情况下,通过 Rep 蛋白的作用,整合到 1 号染色体 AAVS19 位点的宿主基因组中。对于重组 AAV,双链 DNA 仍保持游离状态,从而允许转基因稳定表达而无需整合。这种游离性质提供了一定程度的免疫监视保护,从而实现了持续的基因治疗效果。
七、转基因表达:一旦 AAV 基因组被转化并稳定下来,便可以借助宿主的表达系统进行转录与翻译。载体中所整合的功能片段决定转录沉默或激活。例如,携带强启动子可以导致高水平的转基因表达,而携带shRNA或siRNA序列则可以降低基因表达水平
八、转基因蛋白质生物合成
九、转基因蛋白质的分泌
AAV载体优势
1、AAV是非致病性病毒,目前未发现会引起人类疾病,安全性较高。
2、AAV去除了病毒编码序列,仅保留ITRs,使得其免疫原性和细胞毒性较低,不会长期影响靶细胞的功能。
3、目前AAV载体有几百种血清型和变异体,宿主范围广泛,能够靶向感染多种细胞和组织。
4、AAV载体可实现长期稳定的基因表达,其基因组可形成游离DNA在细胞中持续存在。
基于这些优势,AAV被认为是目前最适合在体研究基因功能的利器。
总 结
AAV载体就像一辆精心设计的“基因快递车”,能将特定的遗传指令精准递送到特定的目标细胞中。
通过搭载不同的基因“货物”,研究人员可以利用AAV实现多种研究目的:例如,通过引入功能基因拷贝实现基因过表达,或者利用shRNA或CRISPR系统进行基因干扰、敲除乃至精确编辑。
这些强大功能使AAV成为基因功能研究、疾病模型构建(如神经退行性疾病、遗传性眼病模型)、高通量基因功能筛选以及细胞信号通路解析等前沿科研领域的核心工具之一。
吉满服务
吉满生物深度布局AAV领域,可为您提供从基因操控到工具应用的一站式、高水平AAV解决方案,满足您不同的科研需求。凭借领先的技术工艺、卓越的管理体系和严格的QC验证,吉满生物可提供高滴度、高转染效率、低内毒素、货期短的AAV现货产品及定制服务。
我们的核心服务涵盖四大维度,精准匹配您的多元科研需求:
干扰AAV
想要敲低特定基因,深入探究其功能?我们提供全方位的干扰定制服务。无论是常规编码基因,还是极具挑战性的lncRNA、miRNA、circRNA等非编码RNA,我们都能为您量身打造高效的shRNA干扰工具,实现基因表达的精准下调。
过表达AAV
需要验证基因功能增益表型?我们的过表达平台是您的理想选择。服务覆盖普通编码基因的过表达,更特别支持miRNA、lncRNA、circRNA等非编码RNA的过表达载体构建,助您轻松实现目的基因的高水平表达。
AAV包装与扩增
手握质粒,急需获得高滴度、高纯度的AAV病毒?您只需提供核心质粒,我们专业的团队将负责完成从病毒包装、扩增到纯化的全流程工作,确保您能快速获得即用型高品质病毒液,省时省力。
即用型AAV现货产品
我们的现货产品库种类齐全,涵盖光遗传、化学遗传、钙指示蛋白、Cre重组酶等多种热门工具,并配备多种特异性启动子和广泛的血清型,可以满足您对不同组织嗜性和细胞特异性的转导需求。
AAV现货清单(部分)
参考文献:
[1] Suarez-Amaran L, Song L, Tretiakova A P, et al. AAV Vector Development, Back to the Future. Molecular Therapy. 2025, 33(05): 1903-1936. https://doi.org/10.1016/j.ymthe.2025.03.064.
[2] Wang D, Tai P W and Gao G. Adeno-associated Virus Vector as a Platform for Gene Therapy Delivery. Nature Reviews Drug Discovery. 2019, 18(05): 358-378. https://doi.org/10.1038/s41573-019-0012-9.
[3] Wang J H, Gessler D J, Zhan W, et al. Adeno-associated Virus as a Delivery Vector for Gene Therapy of Human Diseases. Signal Transduction and Targeted Therapy. 2024, 9:78. https://doi.org/10.1038/s41392-024-01780-w.
[4] Tan F Z, Dong Y, Qi J Y, et al. Artificial Intelligence-Based Approaches for AAV Vector Engineering. Advanced Science. 2025, 12(09): 2411062. https://doi.org/10.1002/advs.202411062.
[5] Zwi-Dantsis L, Mohamed S, Massaro G, et al. Adeno-Associated Virus Vectors: Principles, Practices, and Prospects in Gene Therapy. Viruses. 2025, 17(02):239. https://doi.org/10.3390/v17020239.
[6] Issa S S, Shaimardanova A A, Solovyeva V V, et al. Various AAV Serotypes and Their Applications in Gene Therapy: An Overview. Cells. 2023, 12(05): 785. https://doi.org/10.3390/cells12050785.
[7] Li C and Samulski R J. Engineering Adeno-associated Virus Vectors for Gene Therapy. Nature Reviews Genetics. 2020, 21(04): 255-272. https://doi.org/10.1038/s41576-019-0205-4.
[8] McCarty D M. Self-complementary AAV Vectors; Advances and Applications. Molecular Therapy. 2008, 16(10): 1648-1656. https://doi.org/10.1038/mt.2008.171.
[9] Batty P and Lillicrap D. Hemophilia Gene Therapy: Approaching the First Licensed Product. HemaSphere. 2021, 5(03):e540. https://doi.org/10.1097/HS9.0000000000000540.
[10] Pupo A, Fernández A, Low S H, et al. AAV Vectors: The Rubik's Cube of Human Gene Therapy. Molecular Therapy. 2022, 30(12): 3515-3541.https://doi.org/10.1016/j.ymthe.2022.09.015.