实验干货
神经系统疾病是全球致残的主要原因和第二大死亡原因,包括神经功能性和退行性疾病,如帕金森病 (Parkinson's disease, PD)、阿尔兹海默症 (Alzheimer disease, AD)、脊髓性肌萎缩症 (Spinal muscular atrophy, SMA)、肌萎缩侧索硬化症 (Amyotrophic lateral sclerosis, ALS)等。
由于神经系统细胞类型的高度异质性(如神经元、星形胶质细胞、少突胶质细胞、小胶质细胞)以及血脑屏障(Blood-brain barrier,BBB)这一特殊结构的存在,传统研究方法在探索特定神经细胞功能、解析发病机制和开发有效治疗策略时面临诸多挑战。
腺相关病毒(Adeno-associated virus, AAV)载体因其安全性高、免疫原性低、能够实现外源基因在特定细胞类型中长期、稳定表达等特点,现已成为神经科学研究中的重要工具。而要成功利用AAV在复杂的神经系统中实现对特定细胞类型的精准基因调控,关键在于选择合适的AAV血清型、细胞特异性启动子,以及高效的递送(注射)方式。
神经系统血清型选型全攻略
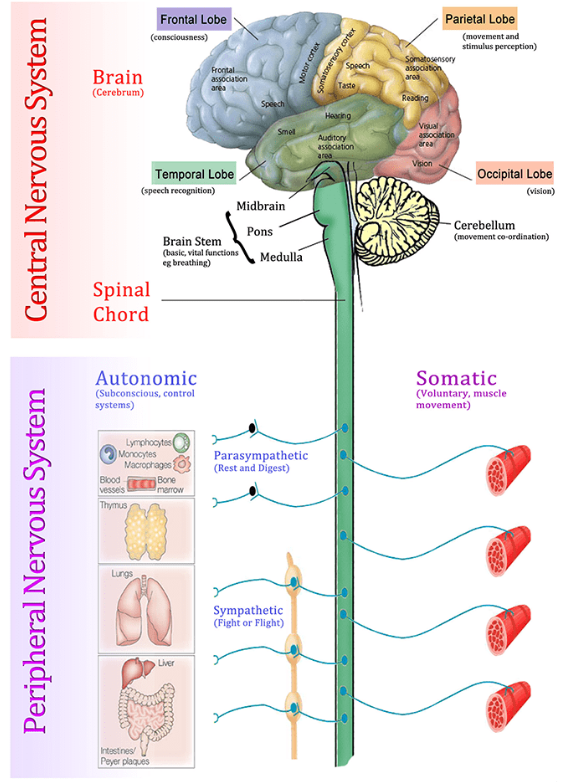
神经系统分为中枢神经系统(Central nervous system, CNS)和外周神经系统(Peripheral nervous system, PNS)。
CNS主要包括脑(Brain)和脊髓(Spinal Cord),是神经系统的核心部分,负责信息整合与发出指令,对机体的生理活动和行为反应起着主导作用;
PNS则由脑神经和脊神经组成,遍布全身,负责连接CNS与身体各部,传递感觉信息与运动指令,实现机体与外界环境的交互。
图1 神经系统结构组成[1]
外周神经
推荐使用血清型AAV- PHP.S、AAV- rh10、AAV9
AAV9是应用广泛的血清型,能穿过血脑屏障,全身注射可感染脊髓运动神经元,对PNS有良好的感染效果[2]。
AAV- rh10和AAV9效率相似甚至更高,当低剂量注射时,AAV- rh10比AAV9更有效地转导脊髓背侧和下运动神经元[3]。此外,AAVrh10在骨骼肌组织中具有感觉神经元趋向性,非常适合用于骨痛等相关研究。
AAV- PHP.S由AAV9改进而来,不仅扩散能力强,在外周神经系统中的转导效率也比AAV9更高,且可转导82%的背根神经节、心脏和肠神经元、以及一系列外周器官,尤其适合需要广泛标记PNS的研究[4]。
脊髓
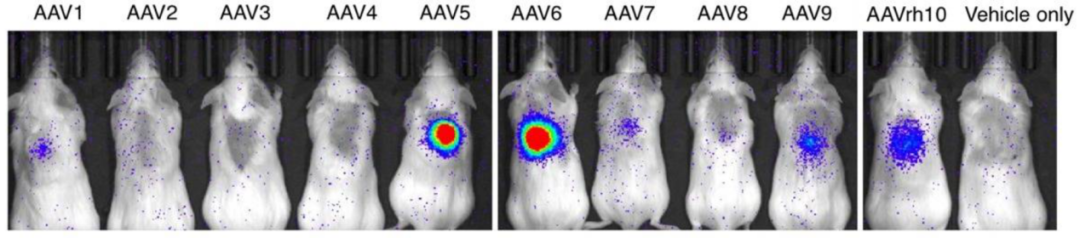
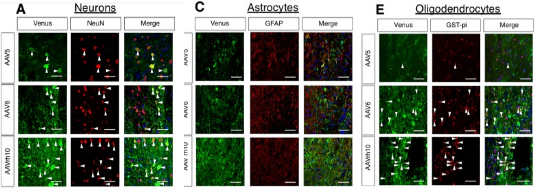
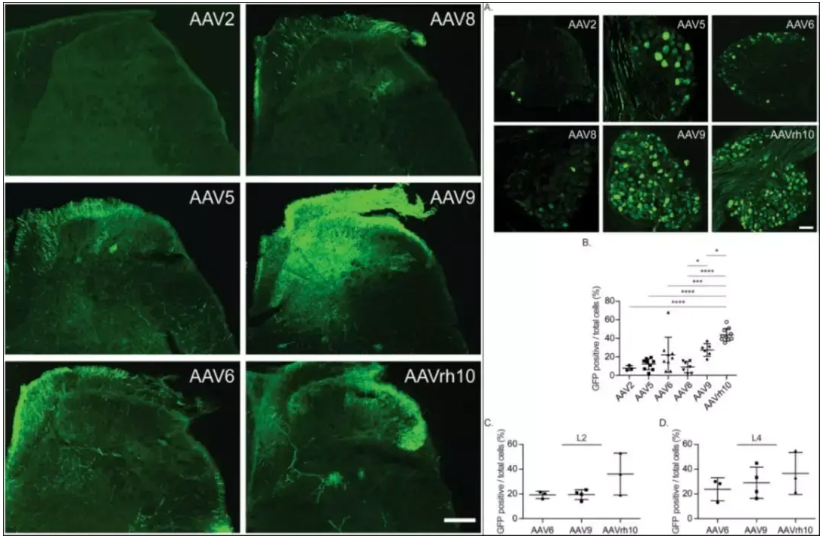
AAV5、AAV6、AAV9和AAV- rh10均可以实现对完整小鼠脊髓的有效转导(图2)。其中AAV- rh10对神经元和神经胶质细胞具有更高的趋向性(图3),是在慢性期损伤脊髓中进行基因递送/转移的最合适的血清型[5]。
图2 AAV1-9和AAV-rh10对完整小鼠脊髓的有效转导
图3 慢性期损伤脊髓中AAV5、AAV6和AAV- rh10 的 细胞趋向性
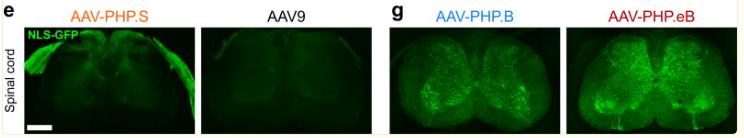
AAV- PHP. eB、AAV-PHP. B和AAV- PHP.S由AAV9改造而来,可以实现小鼠脊髓的高效转导,且通过系统注射即可,操作方便。此外鞘内注射后,AAV9变体衣壳AAV-F也能介导非人灵长类动物脊髓中广泛的转基因表达[6]。
图4 不同AAV血清型静脉注射后
横断脊髓切片荧光图[4]
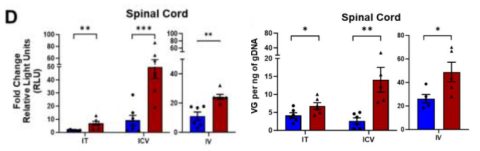
在小鼠中,AAV-DJ在体外和体内都表现出强大的转导效率,在靶向脊髓的同时去靶向肝和肾方面更优越。
图5 靶向脊髓的病毒滴度和荧光素酶
转基因转录水平[7]
研究人员通过髓鞘注射AAV2、AAV5、AAV6、AAV8、AAV9、AAV- rh10等六种血清型,发现在脊髓背角AAV9和AAV- rh10血清型转导效率最高,且对背根神经节的感染效率也显著高于其它血清型。
图6 不同AAV血清型感染脊髓效果对比
此外,衣壳工程化改造带来了像AAV.CPP.16这样的新型变体,其在啮齿类和灵长类动物(食蟹猴)中均显示出优于AAV9的血脑屏障穿透能力和脊髓转导效率,为靶向CNS提供了更有力的工具[8]。
全脑感染
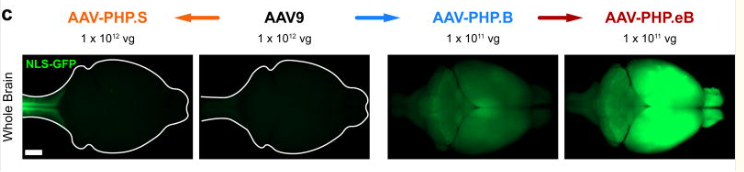
AAV9、AAV- PHP.eB、AAV- PHP.B、AAV-PHP.S,以及上面提到的AAV.CPP.16,这几种血清型均能透过血脑屏障,且扩散性很好。如果对感染效率要求较高,建议使用血清型PHP.eB或PHP.B。
图7 不同AAV感染全脑荧光图[4]
局部脑区
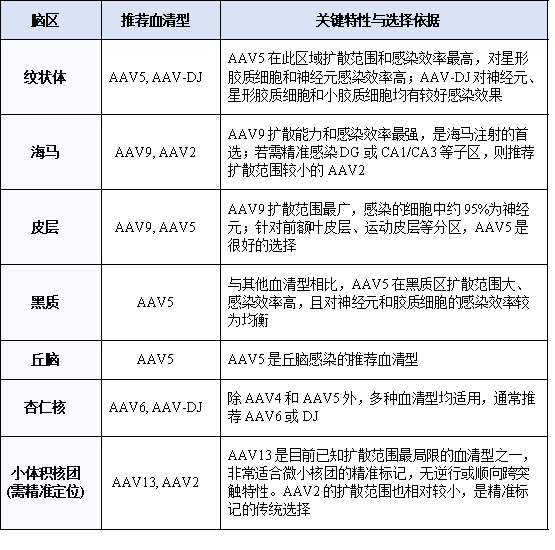
不同脑区由于细胞密度、组织结构和细胞类型的差异,对各类血清型的响应不同。下面的表格汇总了针对不同脑区的推荐血清型及其关键特点。
示踪方向
在顺向示踪(从胞体向轴突末端标记)中,AAV9是常用的非跨突触顺向示踪工具,能够高效标记投射神经元的轴突及其终端区域[9];AAV1在高滴度下可实现顺向跨单突触传播,当其与Cre依赖的报告系统结合时,能特异性地标记突触后神经元,从而解析局部微环路连接[10]。此外研究表明,自互补型scAAV1的跨突触标记效率更优[11]。
在逆向示踪(从轴突末端回溯至胞体)方面,AAV2-retro表现出强大的逆向运输能力,可通过轴突末端摄取并高效逆向标记上游神经元,且不跨突触,使其成为解析神经元输入来源的利器[12][13]。AAV11也被证明具备优秀的逆行标记能力,并能特异性靶向星形胶质细胞[14]。此外,AAV-ROOT能特异性逆向标记支配外周器官(如脂肪组织)的背根神经节(DRG)感觉神经元,实现对脂肪组织神经支配的特异性操控[15]。
靶向特定细胞
AAV11可高效靶向星形胶质细胞[14];
AAV5在大鼠皮层细胞原代培养中表现出胶质细胞嗜性[16];
AAV-cMG.WPP和 AAV-cMG.QRP显著提高病毒对体外培养的小鼠小胶质细胞的侵染效率;
AAV-MG1.1/1.2能够在体内高效且特异性地转导小胶质细胞而不引起明显免疫激活[17];
AAV-BI30可转导成年C57BL/6小鼠大脑、视网膜和脊髓血管系统中的大多数动脉、毛细血管和静脉内皮细胞[18];
AAV. CAP-B10 表现出对中枢神经系统的特异性,高度靶向神经元细胞[19];
精准原位标记
AAV13具有更小的扩散范围,且未表现出逆行标记或顺向跨突触特性,非常适合作为脑实质内精准原位标记工具[20]。
吉满生物提供丰富的AAV血清型选择,包括AAV1, 2, 5, 6, 7, 8, 9, DJ, DJ/8, rh10, PHP.S, PHP.eB, Retro, CAP-B10, MG1.2等,全面覆盖从全脑广泛感染到特定核团精准标记,从中枢神经系统到外周神经系统的各类研究需求。
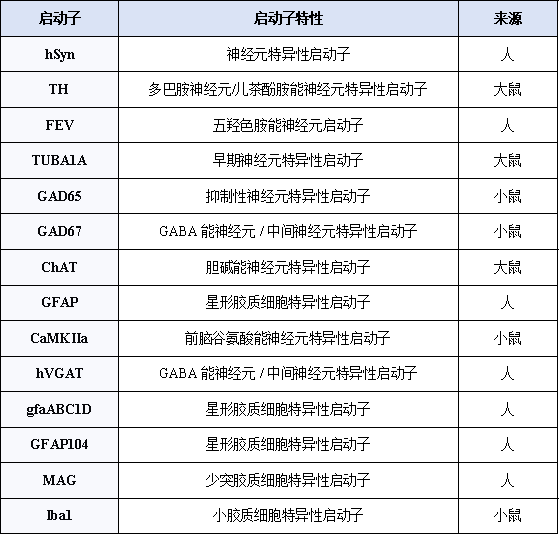
关于启动子的选择
目前,在神经科学研究中被广泛使用的广谱型启动子,如CMV、CAG、EF1A等,吉满生物均可提供,帮助实现目的基因在神经系统的靶向调控。
如果对特定细胞类型表达有要求的,吉满生物也推出神经系统特异性启动子,并支持个性化定制。将血清型的趋向性与细胞特异性启动子相结合,可以实现更加精准的基因表达调控。
选择策略与注意事项
√ 特异性vs强度
广谱启动子(如CAG)能提供高表达水平,但缺乏细胞特异性;细胞特异性启动子(如hSyn, GfaABC1D)精准度高,但表达水平可能稍低,需要根据实验目的权衡选择。
√ 载体容量限制
AAV的包装容量有限(~4.7 kb)。启动子的大小直接影响可用于容纳目的基因的空间,较长的启动子装载的目的基因长度有限。
√ 物种保守性
许多启动子(如hSyn, CaMKIIα)在啮齿类和非人灵长类动物中具有保守性,但表达模式可能存在物种差异,需通过预实验验证。
√ 组合使用
为实现更复杂的遗传操控,可以考虑将启动子与Cre-LoxP、DIO(双翻转)或化学遗传学/光遗传学工具结合使用。例如,使用细胞特异性启动子表达Cre重组酶,再与在目的脑区注射的Cre依赖性AAV(如DIO-AAV)配合,实现极高的特异性。
总结而言, 在AAV应用领域,精准的神经科学研究,始于对血清型和启动子的深刻理解与正确选择。
吉满生物有强大的资源平台、可靠的质量体系、丰富的项目经验和专业的服务团队,无论您的研究处于基础机制探索还是复杂疾病模型构建阶段,吉满生物都能提供精准匹配的技术方案。
下一篇,我们将深入讲解AAV的注射方式——从全身注射到精准的脑立体定位注射,如何根据实验设计做出最佳选择?敬请关注!
吉满生物14周年庆
恰逢吉满生物14周年庆典,我们诚意推出明星产品特惠活动——质粒构建、病毒包装、细胞株构建三大核心产品全线优惠,统统都降至冰点价。
如果您对我们的产品和技术服务有任何需求,欢迎随时联系,我们将竭诚为您服务。

参考资料:
[1] Nervous System Anatomy and Physiology.
https://nurseslabs.com/nervous-system/
[2] Bedbrook C N, Deverman B E, Gradinaru V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Annual Review of Neuroscience. 2018, 41: 323-348.doi:10.1146/annurev-neuro-080317-062048.
[3] Tanguy Y, Biferi M G, Besse A, et al. Systemic AAVrh10 Provides Higher Transgene Expression than AAV9 in the Brain and the Spinal Cord of Neonatal Mice. Frontiers in Molecular Neuroscience, 2015, 8: 36. DOI: 10.3389/fnmol.2015.00036.
[4] Chan K Y, Jang M J, Yoo B B, et al. Engineered AAVs for Efficient Noninvasive Gene Delivery to the Central and Peripheral Nervous Systems. Nature Neuroscience, 2017, 20(08): 1172-1179. DOI: 10.1038/nn.4593.
[5] Hoshino Y, Nishide K, Nagoshi N, et al. The Adeno-Associated Virus rh10 Vector is an Effective Gene Transfer System for Chronic Spinal Cord Injury. Scientific Reports, 2019, 9(01): 9844. DOI: 10.1038/s41598-019-46069-z.
[6] Beharry A, Gong Y, Kim J C, et al. The AAV9 Variant Capsid AAV-F Mediates Widespread Transgene Expression in Nonhuman Primate Spinal Cord After Intrathecal Administration. Human Gene Therapy, 2022, 33(01-02): 61-75. DOI: 10.1089/hum.2021.069.
[7] Chauhan M, Daugherty A L, Khadir F E, et al. AAV-DJ is Superior to AAV9 for Targeting Brain and Spinal Cord, and De-targeting Liver across Multiple Delivery Routes in Mice. Journal of Translational Medicine, 2024, 22(01): 824. DOI: 10.1186/s12967-024-05599-5.
[8] Yao Y, Wang J, Liu Y, et al. Variants of the Adeno-Associated Virus Serotype 9 with Enhanced Penetration of the Blood-Brain Barrier in Rodents and Primates. Nature Biomedical Engineering, 2022, 6(11): 1257-1271. DOI: 10.1038/s41551-022-00938-7.
[9] Green F, Samaranch L, Zhang H S, et al. Axonal Transport of AAV9 in Nonhuman Primate Brain. Gene Therapy, 2016, 23(06): 520-526. DOI: 10.1038/gt.2016.24.
[10] Zingg B, Chou X L, Zhang Z G, et al. AAV-Mediated Anterograde Transsynaptic Tagging: Mapping Corticocollicular Input-Defined Neural Pathways for Defense Behaviors. Neuron, 2017, 93(01): 33-47. DOI: 10.1016/j.neuron.2016.11.045.
[11] Zingg B, Peng B, Huang J, et al. Synaptic Specificity and Application of Anterograde Transsynaptic AAV for Probing Neural Circuitry. Journal of Neuroscience, 2020, 40(16): 3250-3267. DOI: 10.1523/JNEUROSCI.2158-19.2020.
[12] Qiu L, Zhang B and Gao Z. Lighting Up Neural Circuits by Viral Tracing. Neuroscience Bulletin, 2022, 38(11): 1383-1396. DOI: 10.1007/s12264-022-00860-7.
[13] Tervo D G, Hwang B Y, Viswanathan S, et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron, 2016, 92(02): 372-382. DOI: 10.1016/j.neuron.2016.09.021.
[14] Han Z P, Luo N S, Ma W, et al. AAV11 Enables Efficient Retrograde Targeting of Projection Neurons and Enhances Astrocyte-Directed Transduction. 2022, 14: 3792. DOI: https://doi.org/10.1038/s41467-023-39554-7.
[15] Wang Y, Leung V H, Zhang Y, et al. The Role of Somatosensory Innervation of Adipose Tissues. Nature, 2022, 609(7927): 569-574. DOI: 10.1038/s41586-022-05137-7.
[16] Howard D B, Powers K, Wang Y, et al. Tropism and Toxicity of Adeno-Associated Viral Vector Serotypes 1, 2, 5, 6, 7, 8, and 9 in Rat Neurons and Glia in Vitro. Virology. 2008, 372: 24-34. DOI: 10.1016/j.virol.2007.10.007.
[17] Sun J, Zheng Y F and Hu J. Targeting Microglia with Adeno-associated Viruses. Neuroscience Bulletin, 2023, 39(05): 863-865. DOI: 10.1007/s12264-022-00975-x.
[18] Krolak T, Chan K Y, Kaplan L, et al. A High-Efficiency AAV for Endothelial Cell Transduction Throughout the Central Nervous System. Nature Cardiovascular Research, 2022, 1(04): 389-400. DOI: 10.1038/s44161-022-00046-4.
[19] Goertsen D, Flytzanis N C, Goeden N, et al. AAV Capsid Variants with Brain-Wide Transgene Expression and Decreased Liver Targeting after Intravenous Delivery in Mouse and Marmoset. Nature Neuroscience, 2022, 25(01): 106-115. DOI: 10.1038/s41593-021-00969-4.
[20] Han Z, Luo N, Wu Y, et al. AAV13 Enables Precise Targeting of Local Neural Populations. International Journal of Molecular Sciences, 2022, 23(21): 12806. DOI: 10.3390/ijms232112806.