文献来源
2023年6月22日,南京大学医学院徐运、朱晓蕾教授团队在JCI insight上发表了"MiR-431 attenuates synaptic plasticity and memory deficits in APPswe/PS1dE9 mice"的研究论文。
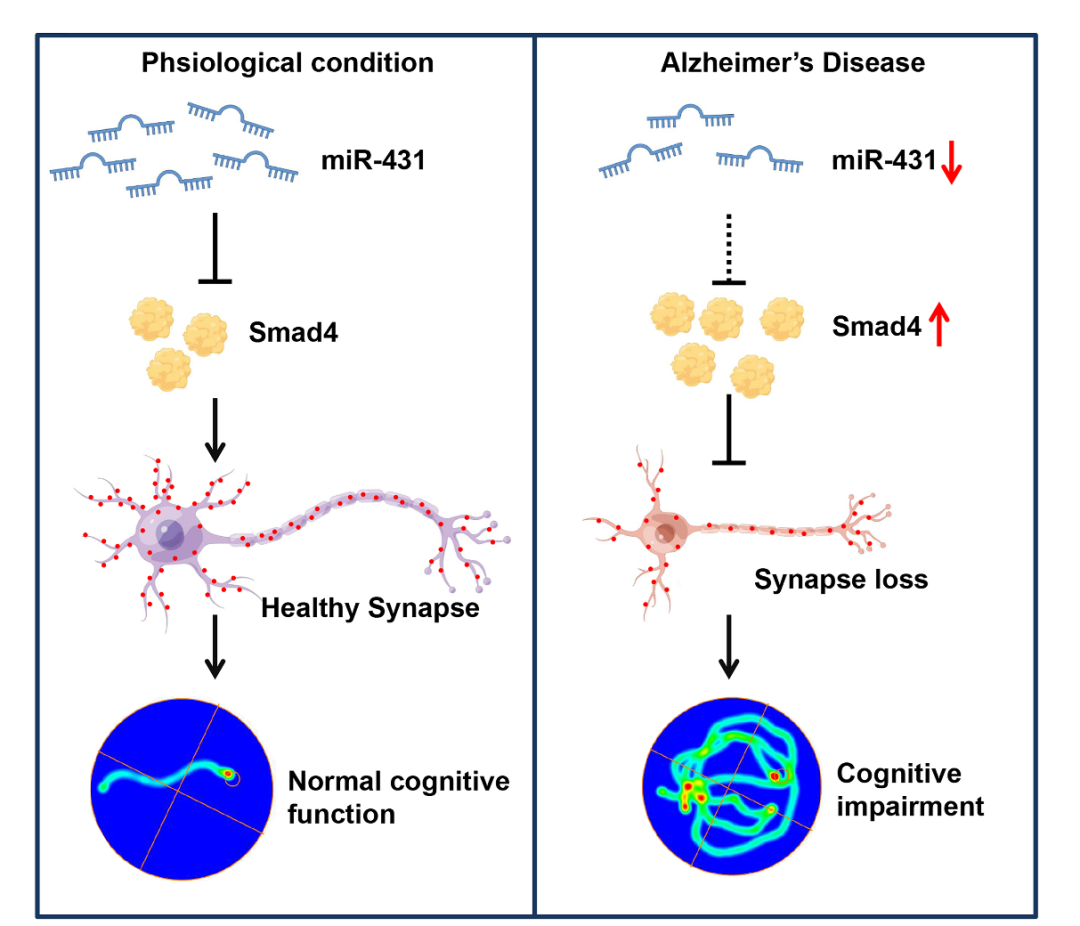
该工作团队首次发现miR-431在APP/PS1小鼠(AD模型)血浆及海马中显著下调,并且 miR-431在aMCI、AD患者血浆中也显著下调。此外,APP/PS1小鼠海马中过表达miR-431能够显著改善神经元突触可塑性,进而提高其记忆和认知功能。该研究对阿尔兹海默病的发病机制和防治提了一个新的观点,并为AD的诊断和治疗提供了新的思路。
研究背景
目前全世界有5000万痴呆患者,且每年增长约460万,预计至2050年,其数目将突破1.3亿,阿尔茨海默病(AD)是痴呆的最主要类型,占痴呆的60%-80%。AD是一种神经系统退行性疾病,其特征是进行性认知功能下降,行为和人格改变。尽管AD的病理机制尚不完全清楚,但突触缺失被认为是AD的早期病理标志。并且与阿尔茨海默氏症的认知障碍密切相关。因此,逆转突触功能障碍有望挽救与阿尔茨海默病相关的记忆缺陷。
MicroRNAs是一组长度为18-22个核苷酸的非编码小RNA,通过与靶mRNA的3 ' -UTR结合抑制蛋白翻译,在AD发病中起着至关重要的作用。
项目研究
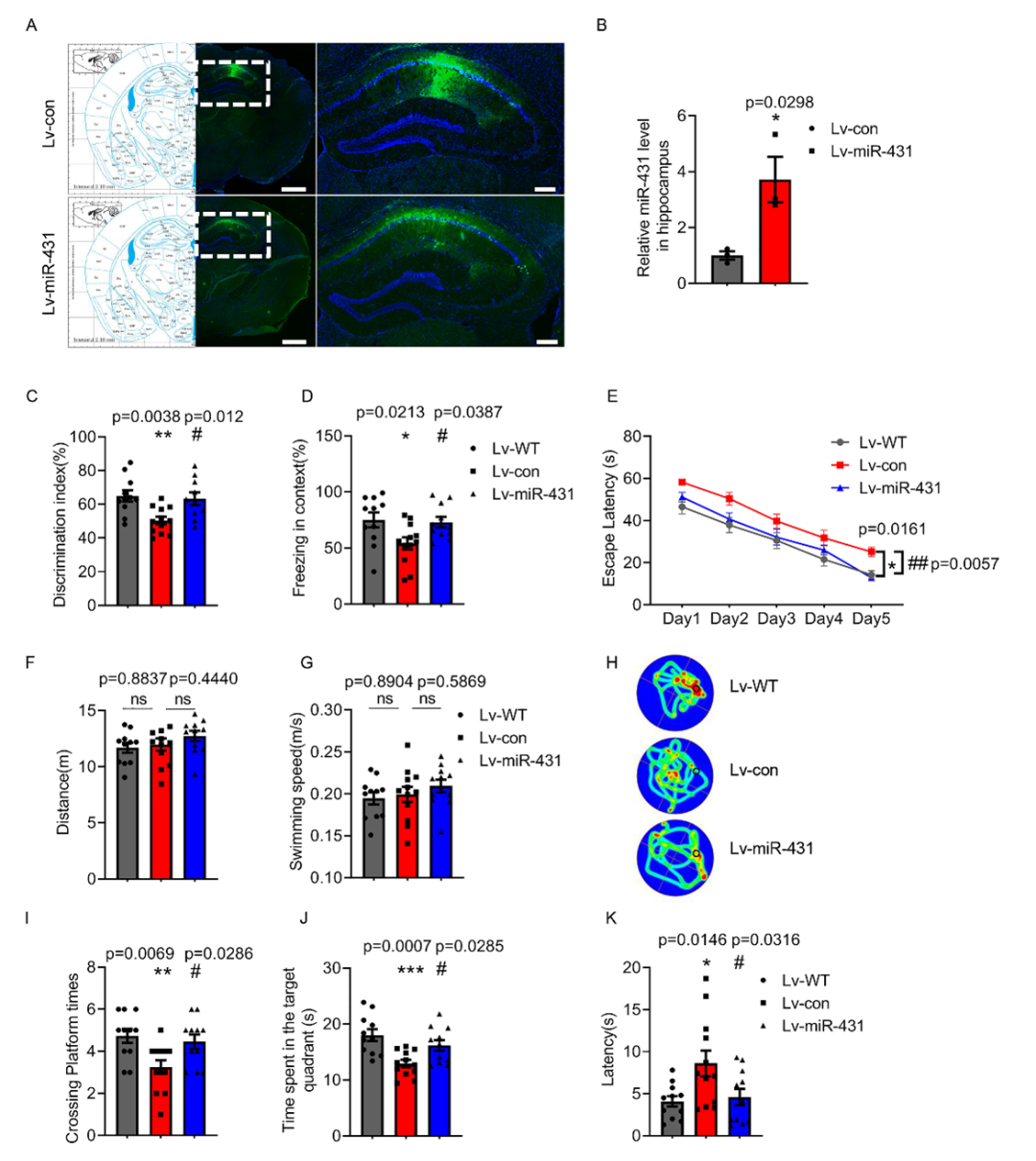
在该项目研究中,团队首先在APP/PS1小鼠海马中注射miR-431过表达慢病毒。在之后的行为学实验中发现,过表达miR-431能够显著改善APP/PS1小鼠认知功能。
(图1 MiR-431可减轻6月龄APP/PS1小鼠的记忆缺陷)
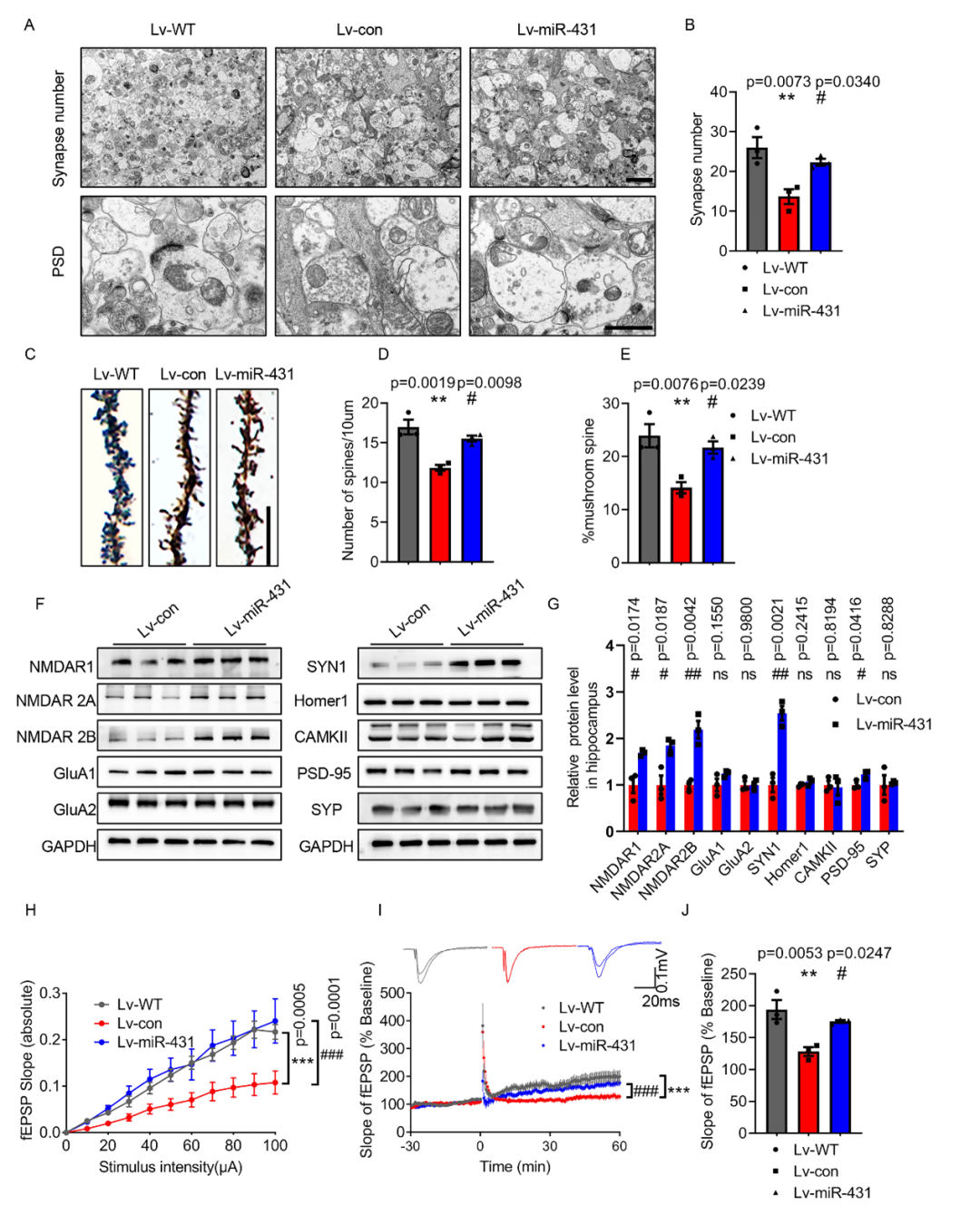
进一步地,通过电镜,高尔基染色实验,蛋白免疫印迹实验以及全细胞膜片钳实验发现,在APP/PS1小鼠海马内过表达miR-431能够显著改善其突触可塑性。
(图2 MiR-431过表达可改善6月龄APP/PS1小鼠的突触可塑性)
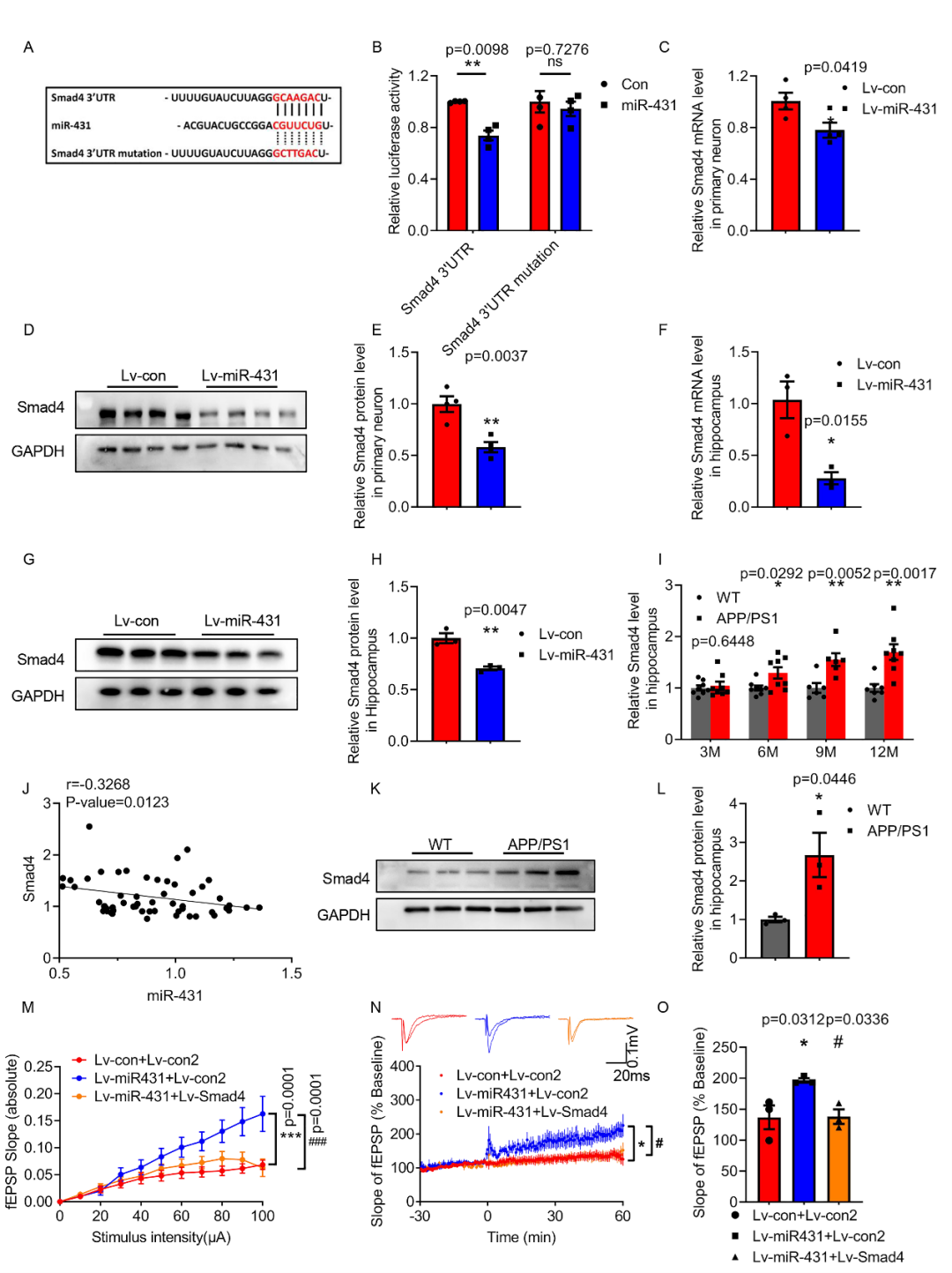
最后,团队通过在体内外探究其可能的靶点,通过实时定量PCR实验,蛋白免疫印迹实验以及荧光素酶报告基因试验发现并证实了Smad4是miR-431的靶点之一,且在小鼠海马中Smad4的mRNA水平与miR-431的表达量成负相关。随后,在过表达miR-431小鼠中同时过表达Smad4,发现能够抑制miR-431对AD突触功能的改善作用。
(图3 miR-431靶向作用于Smad4)
该研究由南京大学医学院附属鼓楼医院徐运教授、朱晓蕾教授团队完成。葛键炜硕士、薛智伟硕士、舒姝博士为共同第一作者。朱晓蕾教授为通讯作者。该工作得到国家重点研究与发展计划 国家科技创新2030—“脑科学与类脑研究”重大专项、国家自然科学基金、江苏省重点研发计划等项目资助。
吉满助力
本研究中所用Smad4 3’-UTR野生型及突变型荧光素酶质粒,Dlg3启动子野生型及突变型荧光素酶质粒以及Smad4过表达质粒均由吉满生物提供。 如想了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288