7月15日,恒瑞医药与美国Kailera Therapeutics公司共同宣布,GLP-1/GIP双重受体激动剂HRS9531注射液治疗中国肥胖或超重受试者的Ⅲ期临床试验(HRS9531-301)获得积极顶线结果。与安慰剂相比,HRS9531所有剂量组(2mg、4mg、6mg)在共同主要终点及全部关键次要终点上均达到优效性。点击此处了解产品
恒瑞医药计划近期在中国递交HRS9531注射液用于长期体重管理的新药上市申请(NDA),Kailera正在推进HRS9531(KAI-9531)全球临床研发。
HRS9531是恒瑞医药自主研发的胰高血糖素样肽‑1(GLP-1)和葡萄糖依赖性促胰岛素肽(GIP)双重受体激动剂,拟开发用于超重/肥胖及相关合并症、以及2型糖尿病等适应症的治疗。迄今为止,HRS9531已开展多项临床试验,超过2000名中国受试者接受了HRS9531治疗。
2024年5月,HRS9531作为恒瑞医药具有自主知识产权的GLP-1类创新药组合之一,除大中华区以外的全球范围内开发、生产和商业化的独家权利被公司有偿许可给美国Kailera Therapeutics公司。首付款加里程碑付款累计可高达60亿美元,公司还取得Kailera19.9%的股权。Kailera正在全球(大中华区除外)推进HRS9531的临床开发,代号为KAI-9531。
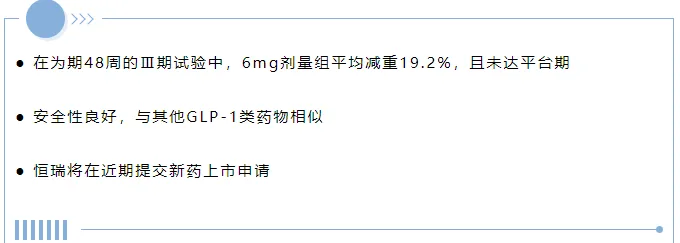
本试验共入组567名肥胖或超重受试者,平均基线体重为93公斤。主要分析(疗法策略)结果表明,HRS9531注射液治疗48周后,平均体重降低最高达17.7%(安慰剂调整后为16.3%),体重降低≥5%的受试者比例达88.0%。此外,高剂量组44.4%的受试者体重降低≥20%。补充分析(假想策略),结果显示,HRS9531治疗组平均体重降低最高达19.2%(安慰剂调整后为17.7%)。 HRS9531显示出良好的安全性和耐受性,与其他GLP-1药物治疗和HRS9531先前报道的Ⅱ期临床数据一致。大多数治疗期间出现的不良事件(TEAEs)为轻度至中度,主要为胃肠道相关事件。 在既往报道的Ⅱ期临床试验结果(NCT06054698)中,主要分析(疗法策略)结果表明,HRS9531注射液8mg治疗36周后平均体重降低22.8%(安慰剂调整后为21.1%),且没有到达平台期,同时具有良好的安全性。补充分析(假想策略)结果显示,HRS9531 8mg平均体重减轻达23.6%(安慰剂调整后为21.7%)。 HRS9531注射液减重Ⅲ期临床试验的完整结果将在即将举行的学术会议上公布。 截至目前,恒瑞医药在国内已获批上市19款1类创新药、4款2类创新药,90余项自主创新产品正在临床开发中,约400项临床试验在全球同步开展。在减重领域方面,目前恒瑞的三靶点激动剂HRS4729目前在临床I期阶段,预期将于今年下半年读出数据。除GLP-1等主流靶点外,恒瑞还在积极开发包括Amylin、Myosin在内的多种具有减重潜力的新靶点。 图源: 恒瑞聆訊後資料集