实验干货
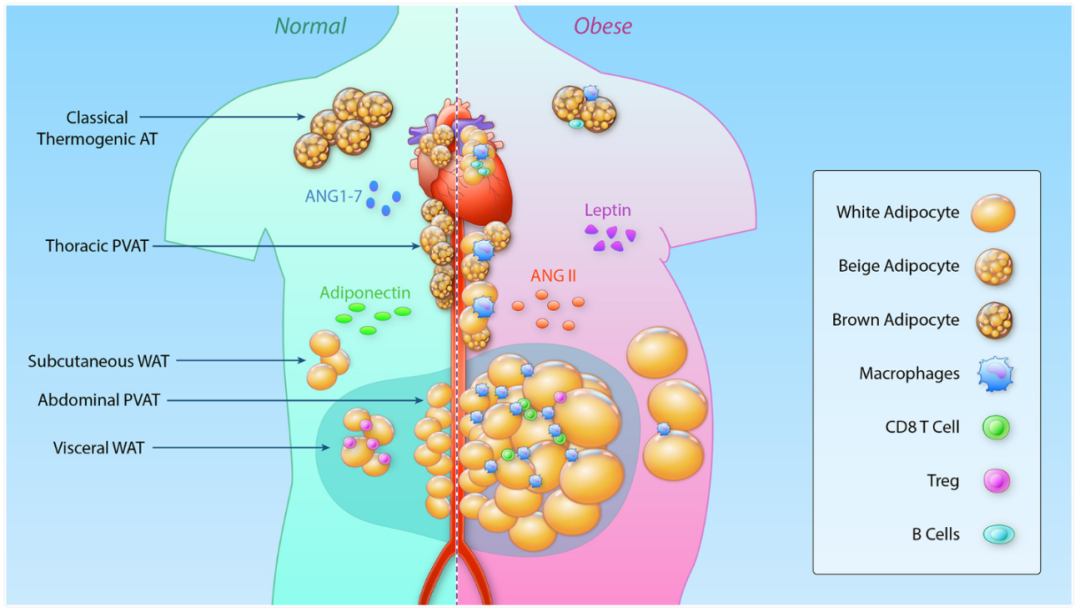
脂肪组织(Adipose tissue, AT),既往被视作单纯的能量储存部位,目前已被广泛认定为人体关键的内分泌与免疫调节中枢,是一个由多种细胞类型组成的复杂体系。
脂肪组织
脂肪组织大体上可划分为两部分:
1)脂肪细胞,主要涵盖储存能量的白色脂肪细胞、具有产热功能的棕色脂肪细胞,以及可由白色脂肪诱导生成的米色脂肪细胞。
2)基质血管部分(SVF),包含前体脂肪细胞、免疫细胞(如巨噬细胞)、内皮细胞和成纤维细胞等多种细胞。
体内平衡和肥胖过程中不同脂肪组织贮量的变化[1]
除储存能量外,脂肪组织可分泌数十种细胞因子、激素及蛋白因子,进而调控全身代谢稳态。
研究工具
肥胖、高血压、2型糖尿病、心血管疾病以及胰岛素抵抗等疾病的发生均与脂肪组织代谢紊乱相关。因此,运用先进技术开展靶向脂肪组织的研究,对于深入了解脂肪功能及代谢具有重要意义。
AAV(腺相关病毒)作为基因靶向递送的明星载体,自然成为研究脂肪组织相关基因功能及代谢调控的得力工具。然而,要利用AAV在脂肪组织中实现精准、高效的基因操作,研究者必须审慎考虑三个关键环节:血清型的选择、启动子的特异性以及递送途径的优化。
血清型选择
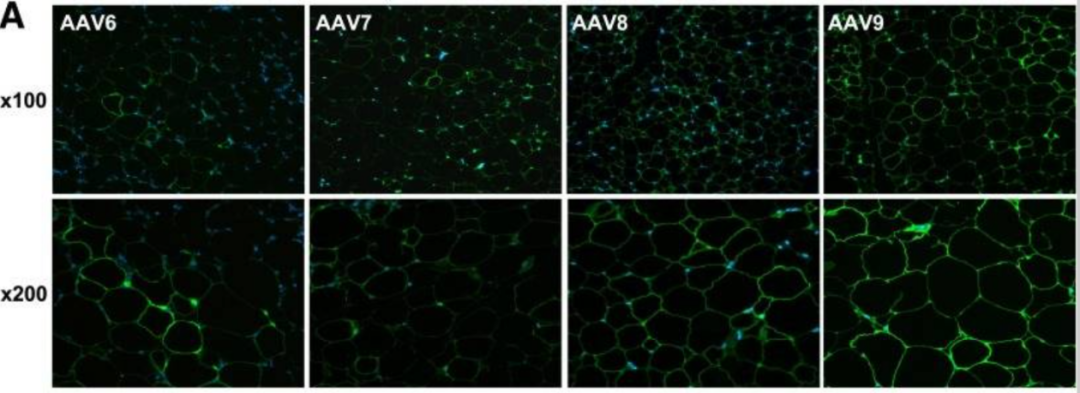
研究发现,AAV8和AAV9在成年瘦型和糖尿病型小鼠模型中均显示出对白色脂肪组织(WAT)和棕色脂肪组织(BAT)较好的转导能力,能够介导长期有效的基因转移[2]。
不同AAV血清型对脂肪组织的侵染效率
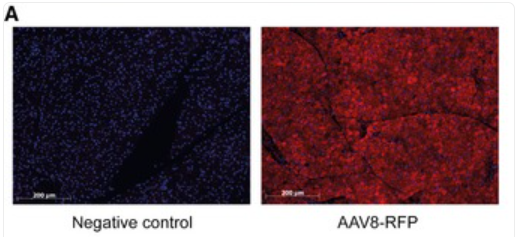
感染AAV8-RFP小鼠的肩胛间棕色脂肪组织免疫染色
尤其是AAV8,注射后在棕色脂肪组织中强烈表达,其携带的HKII过表达显著增强了AdRiKO小鼠棕色脂肪组织中冷刺激诱导的葡萄糖摄取,进而有效逆转由mTORC2失活所引起的体温过低和冷敏感现象[3]。
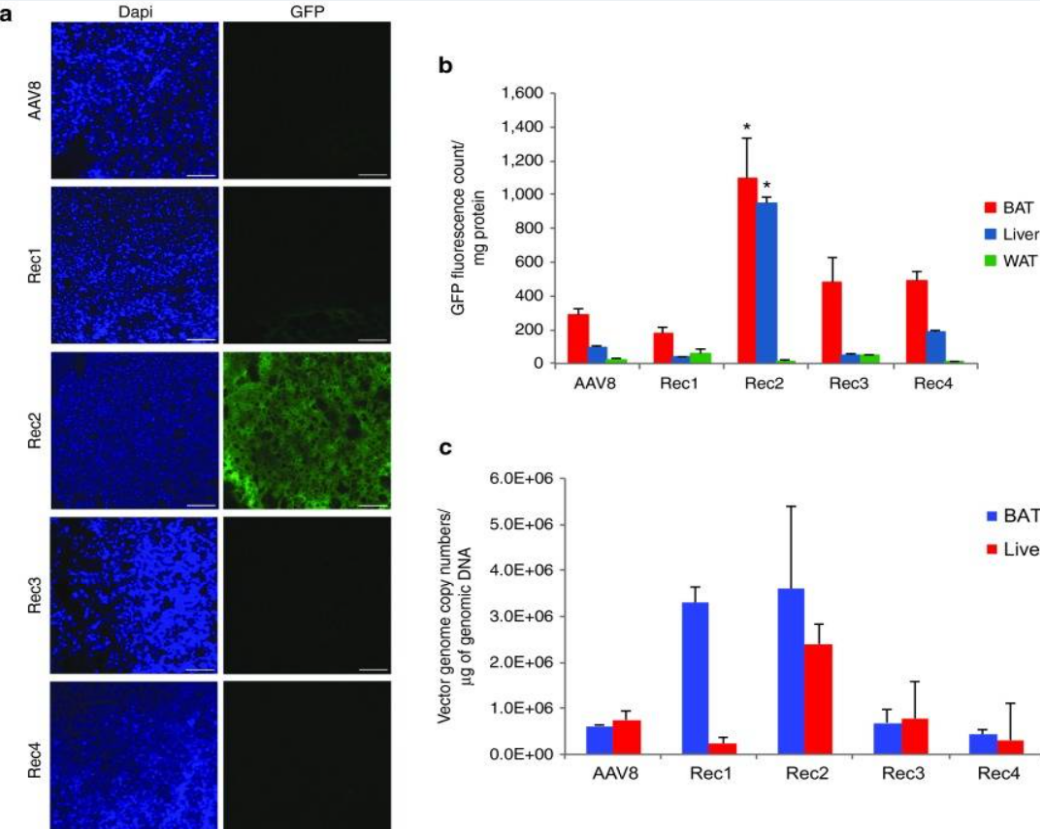
AAV-Rec2
新型工程杂交血清型AAV - Rec2对脂肪组织的转导效率高于天然存在的血清型(AAV1和AAV8)以及其他工程血清型(AAV - Rec1、AAV - Rec3、AAV - Rec4)。
在直接注射脂肪垫的情况下,AAV - Rec2即便处于比天然血清型至少低1 - 2个数量级的低剂量水平,仍能够极为有效地将基因递送至棕色脂肪组织[4]。
不同血清型转导BAT效率比较
AAV-ROOT
研究人员基于AAV9开发了AAV-ROOT血清型,通过使用NNK简并引物(集成DNA技术)在Gibson组装的AAV9的588和589个位点之间插入随机七聚体生成。
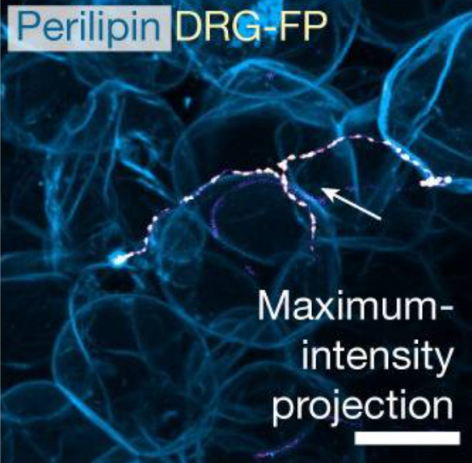
AAV-ROOT具有更高的逆行效率,能够实现对脂肪组织中DRG感觉神经的精准示踪,揭示了其在调节脂肪功能中的作用[5]。
与脂肪细胞紧密附着的DRG纤维示踪
启动子选择
脂肪组织研究中,可以使用广谱表达的常规启动子(如CMV、CAG、U6等),这些启动子能够在多种细胞类型中驱动基因表达,为脂肪组织的基础研究提供稳定的表达平台。同时,针对脂肪细胞特异性表达的启动子也备受关注,它们能够精准调控基因在脂肪细胞中的表达,有助于深入研究脂肪细胞的生理功能和代谢机制。
脂肪细胞特异性启动子
注射方式
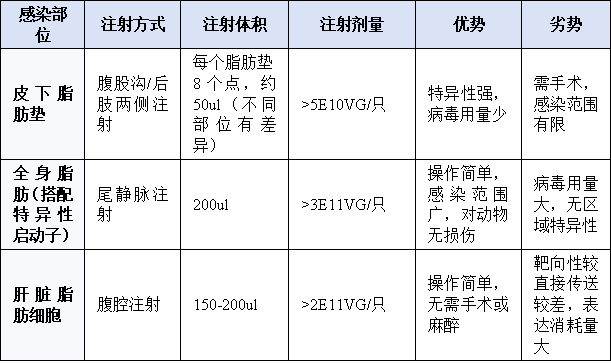
AAV感染脂肪的方式有静脉注射、腹腔注射、腹股沟脂肪垫注射、后肢两侧脂肪垫注射等,每种方式的优缺点不同。具体的注射方式和病毒使用剂量如下:
AAV靶向脂肪注射方式
技术联合创新,助力研究
AAV与Cre-loxP系统联用:实现脂肪细胞的精准基因操控
该联合技术的优势在于,无需进行繁杂的育种操作,即可在成年野生型小鼠(已携带floxed等位基因)的特定脂肪细胞中快速、精准地敲除目标基因,避免了胚胎期重组可能导致的发育缺陷或致死问题,便于研究该在成年期脂肪细胞中的生理病理功能。
应用案例:关于间歇性禁食(IF)诱导脂肪褐变的研究[6]
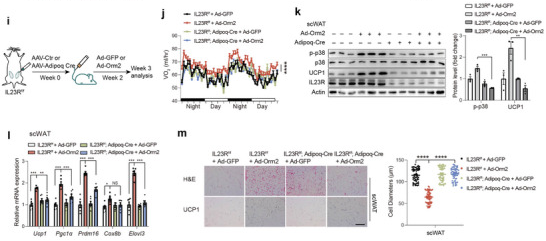
为验证IF诱导的肝因子Orm2是否特异性通过脂肪细胞上的IL-23R受体来介导产热,研究人员将AAV介导的Adipoq-Cre(脂肪细胞特异性启动子驱动Cre重组酶)递送至IL23Rflox/flox小鼠的皮下白色脂肪组织中,高效构建了脂肪细胞特异性IL-23R敲除(IL23R AKO)模型。
研究结果显示,在野生型小鼠中过表达Orm2可成功诱导脂肪褐变,但在IL23R AKO小鼠中,这一效应被完全阻断。
该实验设计精妙地运用了AAV-Cre/loxP系统,不仅排除了IL-23R在其他组织中的作用干扰,更提供了确凿的遗传学证据,直接证明了Orm2/IL-23R轴在脂肪细胞中是驱动产热的必要通路,凸显了Orm2作为肥胖治疗新靶点的潜力。
AAV-Cre/loxP系统揭示Orm2通过IL23R促进脂肪褐变
AAV与CRISPR-CasRx技术联用:拓展脂肪基因功能研究的新手段
该技术核心优势在于,AAV-CasRx可在成年动物中实现快速精准的基因靶向缺失,无需构建动物模型,极大地缩短了研究周期,并且CasRx介导的mRNA敲降效果是可逆的,这大大降低了因永久性基因改变带来的脱靶和长期安全性风险。
通过AAV递送的CRISPR-CasRx系统,研究人员可以将基因敲低严格限定于特定的脂肪细胞类型,进而排除其他组织细胞的间接影响,确保表型变化的因果关系明确。
应用案例:关于骨质疏松(OP)的研究[7]
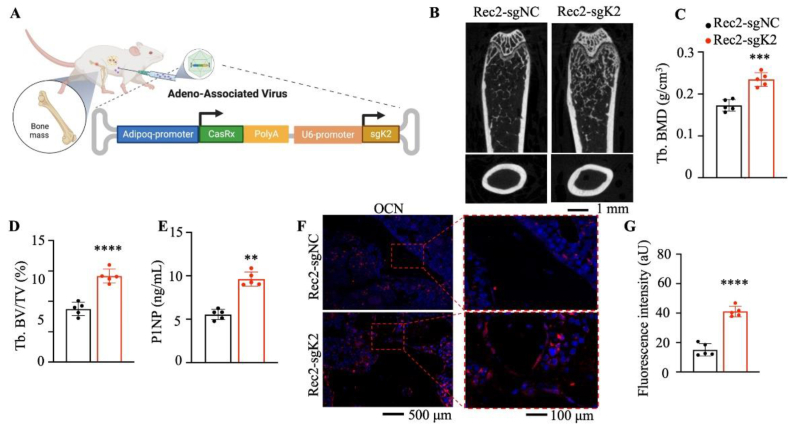
为探究脂肪细胞中Kindlin - 2基因能否作为治疗骨质疏松的新靶点,研究人员构建了由脂肪特异性启动子Adipoq和血清型AAV - Rec2驱动的CasRx - sgRNA系统(AAV-Rec2-CasRx- sgK2),并将其直接注射至野生型小鼠体内。
实验结果显示,仅在脂肪细胞中敲低Kindlin-2,便足以显著提升骨量、促进成骨,同时改善全身胰岛素信号。这充分证实了脂肪细胞与骨代谢之间的内在关联,并将Kindlin-2确定为关键的介导因子。
AAV-CasRx介导的脂肪细胞中Kindlin-2的RNA编辑增加C57BL/6小鼠的骨量
吉满服务
吉满生物拥有十四年的病毒包装服务经验,不仅提供包括过表达、RNA干扰(shRNA)、Cre-Loxp系统等多种功能在内的AAV定制服务,还有超多AAV现货产品,覆盖从基础功能研究到复杂疾病模型构建的广泛需求。
吉满优势
丰富的血清型选择:提供经实验验证的、对脂肪组织具有高亲和力的AAV血清型(如AAV8, AAV9, AAV-Rec等),确保高效递送。
丰富的启动子库:涵盖多种脂肪细胞亚型特异性启动子,满足高特异性表达需求。
专业的注射方案咨询:可提供针对不同脂肪(如皮下脂肪、内脏脂肪)的局部或全身注射方案建议,确保病毒有效抵达靶组织。
成熟的技术联合平台:支持定制携带Cre重组酶、CRISPR组分等复杂元件的AAV病毒,助力开展高难度的基因功能研究。

参考资料:
[1] Koenen M, Hill M A, Cohen P, et al. Obesity, Adipose Tissue and Vascular Dysfunction. Circulation Research. 2021, 128(07): 951-968. DOI: 10.1161/CIRCRESAHA.121.318093.
[2] Jimenez V, Muñoz S, Casana E, et al. In Vivo Adeno-Associated Viral Vector-Mediated Genetic Engineering of White and Brown Adipose Tissue in Adult Mice. Diabetes. 2013, 62(12): 4012-4022. DOI: 10.2337/db13-0311.
[3] Albert V, Svensson K, Shimobayashi M, et al. mTORC2 Sustains Thermogenesis via Akt-Induced Glucose Uptake and Glycolysis in Brown Adipose Tissue. Embo Molecular Medicine. 2016, 8(03): 232-246. DOI: 10.15252/emmm.201505610.
[4] Huang W, McMurphy T, Liu X, et al. Genetic Manipulation of Brown Fat Via Oral Administration of an Engineered Recombinant Adeno-associated Viral Serotype Vector. Molecular Therapy. 2016, 24(06): 1062-1069. DOI: 10.1038/mt.2016.34.
[5] Wang Y, Leung V H, Zhang Y, et al. The Role of Somatosensory Innervation of Adipose Tissues. Nature. 2022, 609(7927): 569-574. DOI: 10.1038/s41586-022-05137-7.
[6] Zhu X J, Wang X R, Wang J G, et al. Intermittent Fasting-Induced Orm2 Promotes Adipose Browning via the GP130/IL23R-p38 Cascade. Advanced Science. 2024, 11(42): e2407789. DOI: 10.1002/advs.202407789.
[7] Tang W, Ding Z, Gao H, et al. Targeting Kindlin-2 in Adipocytes Increases Bone Mass through Inhibiting FAS/PPARγ/FABP4 Signaling in Mice. Acta Pharmaceutica Sinica b. 2023, 13(11): 4535-4552. DOI: 10.1016/j.apsb.2023.07.001.