文献来源
2023年7月12日,吉林大学赖良学、李占军团队在BMC biology上发表“A new compact adenine base editor generated through deletion of HNH and REC2 domain of SpCas9”的研究论文。
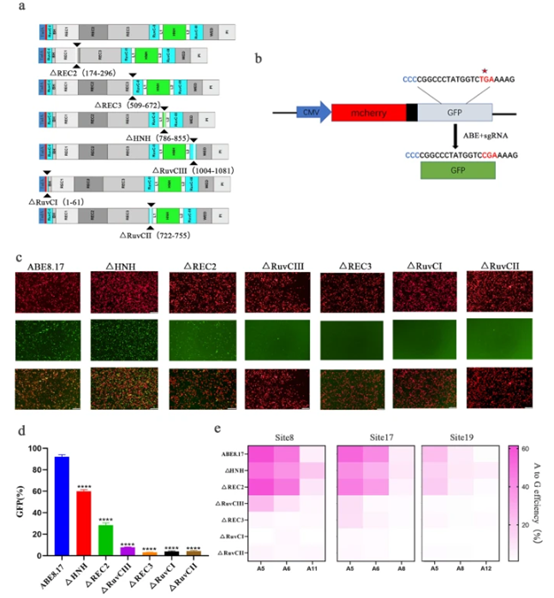
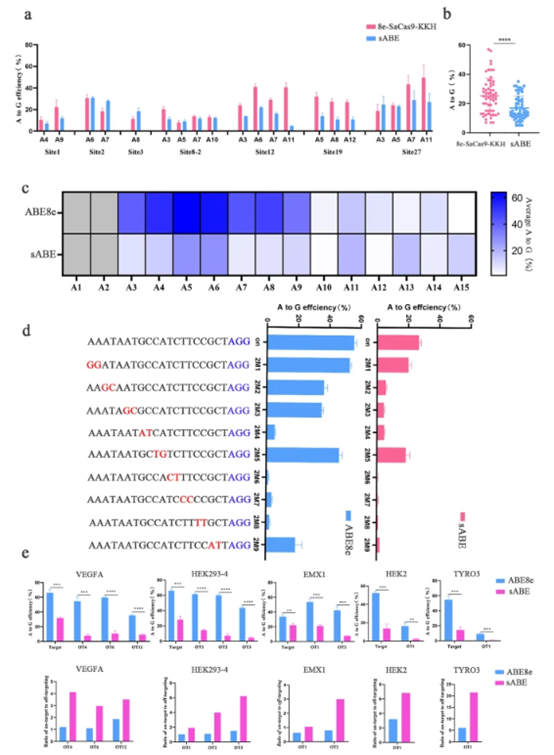
该研究团队发现ABE8e可以容忍SpCas9的REC2(Δ174-296)和HNH(Δ786-855)结构域中的大的单个缺失,并且这些缺失可以堆叠在一起以创建新的sABE。sABE 显示出比原始 ABE8e 更高的精度,具有近端移位的原型间隔子相邻基序 (PAM) 编辑窗口 (A3-A15),并且编辑效率与 8e-SaCas9-KKH 相当。sABE 能够在单个腺相关病毒 (AAV) 载体中进行体内递送,具有一定的编辑效率。此外,还通过将sABE系统的mRNA和sgRNA显微注射到受精卵中,成功地编辑了小鼠胚胎的基因组。该研究表明sABE 系统在临床前应用中具有巨大的治疗潜力。
研究背景
目前基因治疗在如火如荼的进行,然而,SpCas9 (1368 aa) 衍生的基因编辑器及其 sgRNA 的大小太大,无法包装到单个 AAV 载体中以进行有效的体内递送。为了克服这一瓶颈,Cas9 衍生的基因编辑器可以通过内含肽介导的蛋白质拆分成两个较小的部分。另一种策略是开发更紧凑的 Cas9。
在最近的研究中,研究人员成功删除了PE系统中莫洛尼鼠白血病病毒(M-MLV)逆转录酶的RNaseH结构域(621 bp),且不影响prime编辑活性。为了减小 CBE 系统的大小,他们去除了脱氨酶 PmCDA1(261 bp)的 DNA 结合域,并引入了额外的突变以恢复酶功能。因此通过删除某些区域减少载体大小,使载体更适合AAV包装是一种有吸引力的策略。
项目研究
该项目首先在荧光报告系统和内源性位点中评估ABE8.17、AnCBE4max和PE中删除Cas9的不同结构域是否有效。结果发现仅有ABE8.17在报告系统和内源性位点能够有效的容忍HNH,REC2和RuvCIII的缺失。
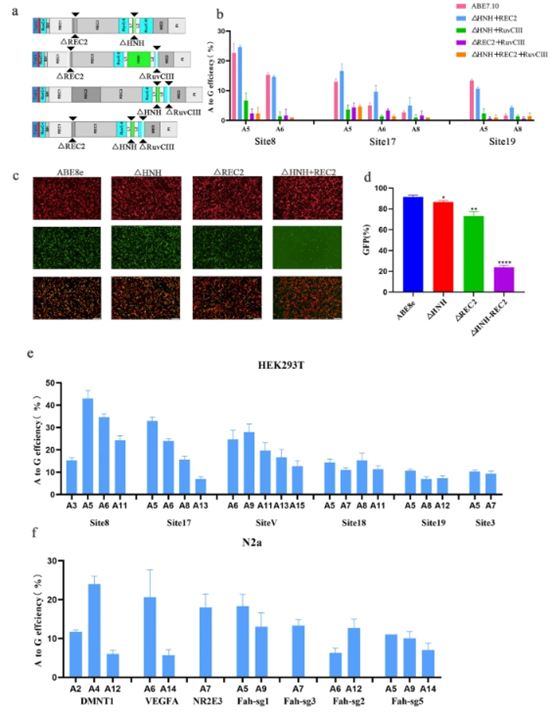
进一步的通过组合三个结构域的缺失以及替换TadA8e,开发出了sABE,它同时删除了HNH和REC2结构域。并且能有效编辑HEK293T细胞和N2a细胞。
随后对sABE进行表征,发现编辑效率和SaCas9-ABE8e效率相当,并且扩大了编辑窗口,提高了精确性。
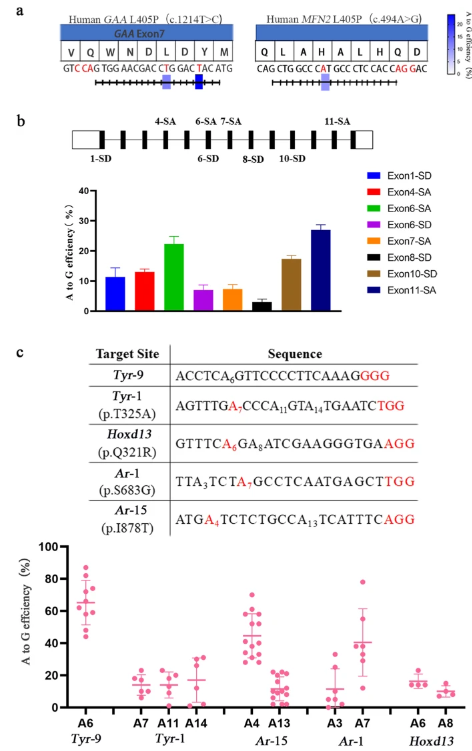
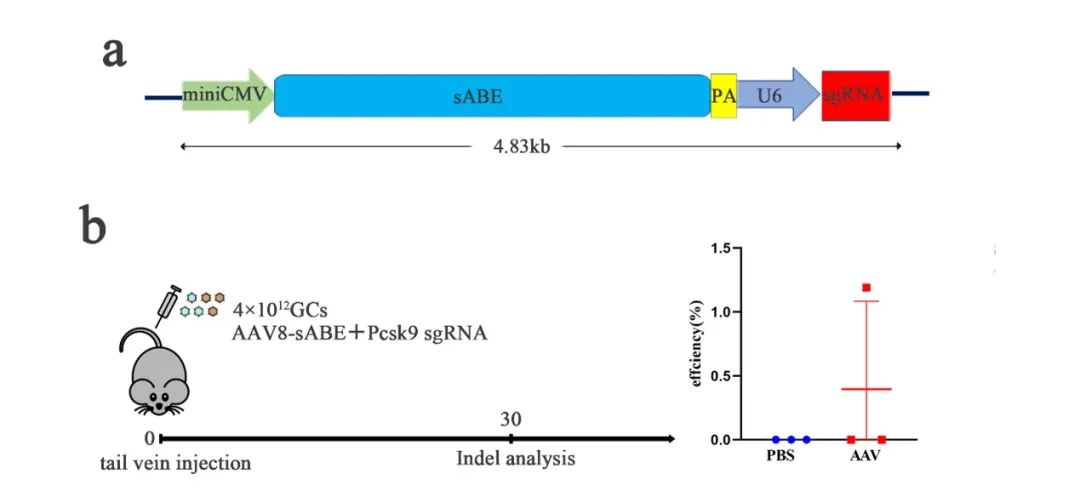
最后将sABE应用于细胞疾病位点和剪切位点验证,并将sABE AAV包被注射到小鼠体内以及小鼠胚胎评估sABE效率。
该研究由吉林大学赖良学教授、李占军教授团队完成。钱育强博士、王迪硕士、牛文超博士为共同第一作者。李占军教授为通讯作者。该工作得到国家自然科学基金项目资助。
吉满助力
本研究中所用AAV8病毒由吉满生物提供。 如想了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288
DOI: 10.1186/s12915-023-01644-9
来源:课题组供稿