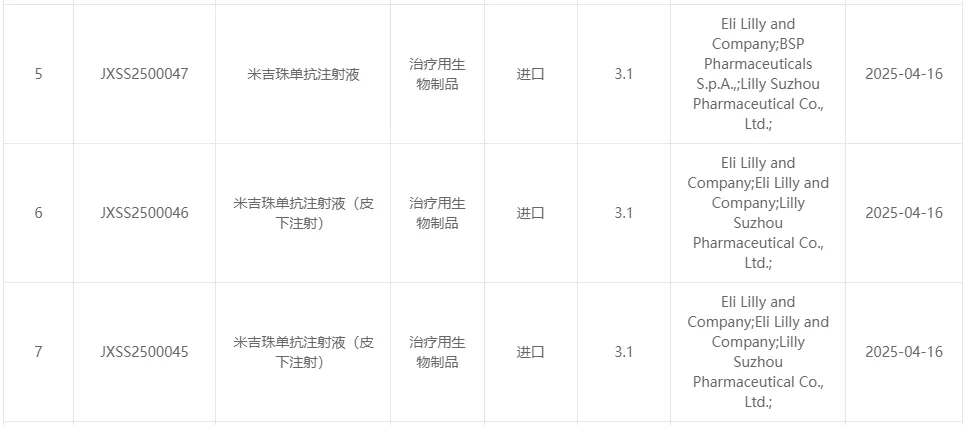
2025年4月16日,CDE官网显示,礼来申报的米吉珠单抗注射液(mirikizumab)及其皮下注射剂型的新适应症上市申请正式获得受理。
根据公开资料推测,本次申报适应症可能为中重度活动性溃疡性结肠炎(UC)成人患者。
截图来源:CDE
这已是米吉珠单抗在中国的第二次上市申请。此前,该药于2024年10月首次提交在华上市申请,适应症为中重度克罗恩病(CD)。
米吉珠单抗是一款人源化IgG4单克隆抗体,靶向IL-23的p19亚基,可有效阻断IL-23介导的炎症通路。
在海外,米吉珠单抗已于2023年10月获得美国FDA批准,用于治疗中重度活动性溃疡性结肠炎,是首款获批用于该适应症的IL-23p19拮抗剂。2025年1月,该药也获批用于成人中重度活动性克罗恩病。
临床方面,米吉珠单抗治疗UC的效果显著。两项关键的全球III期临床研究(UC-1诱导治疗和UC-2维持治疗)显示:
诱导期12周后,65%的患者获得临床应答,24%达到临床缓解,明显优于安慰剂组(应答43%、缓解15%);
在临床缓解的患者中,66%在1年内维持缓解状态,而安慰剂组仅为40%;
事后分析,几乎所有(99%)在1年时达到临床缓解的患者在52周评估结束前至少3个月不使用类固醇。
此外,礼来于2024年10月公布的长期随访数据进一步证实了该药的疗效持久性:
81%的患者实现长期临床缓解;
82%达成长期内镜缓解;
72%实现组织学-内镜黏膜愈合;
79%达到无类固醇临床缓解;
患者的肠道急迫症状评分持续改善。
随着该药物在中国的新适应症申请获受理,未来有望为更多溃疡性结肠炎和克罗恩病患者提供创新治疗方案。
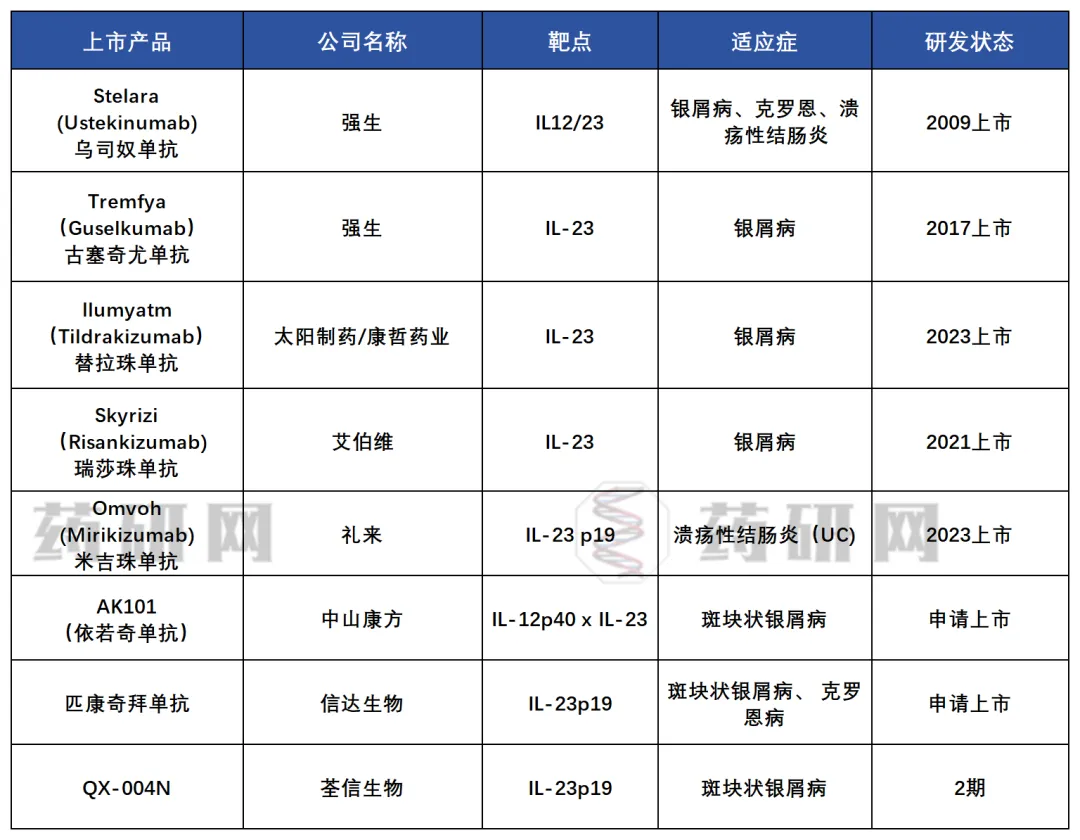
随着自身免疫疾病治疗领域的迅猛发展,IL-23作为关键靶点,已吸引了众多国内外药企的广泛关注与布局。 点击了解IL-23产品详情 目前全球有5种IL-23抗体药物获批,分别为乌司奴单抗、古塞奇尤单抗、替拉珠单抗、瑞莎珠单抗及米吉珠单抗。其中前3款药物已在国内获批,而瑞莎珠单抗及米吉珠单抗在国内的上市申请已获受理。 图.IL-23靶点竞争格局