据其新闻稿:研究结果强化了Amlitelimab作为首个也是唯一一个特应性皮炎治疗方法的潜力,每年可能仅需给药四次,为患者带来更便捷的治疗选择。后续Ⅲ期研究将进一步评估其长期维持疗效及多样化患者群体中的安全性和疗效表现,为全球潜在监管申报提供依据。
Amlitelimab是一种全人源、非T细胞耗竭性单克隆抗体,可阻断关键免疫调节因子OX40L。凭借其新颖的作用机制,amlitelimab 旨在使过度活跃的免疫系统正常化并恢复免疫平衡,而不会耗尽 T 细胞,目标是为患者提供季度给药间隔。它有可能成为一系列免疫介导的疾病和炎症性疾病。点击了解OX40L相关产品
COAST 1研究是一项随机、双盲、安慰剂对照的全球多中心Ⅲ期临床试验,旨在评估Amlitelimab单药皮下注射在601例12岁及以上中重度AD患者中的疗效和安全性。研究的主要目标包括在第24周评估Amlitelimab与安慰剂相比的疗效和安全性。
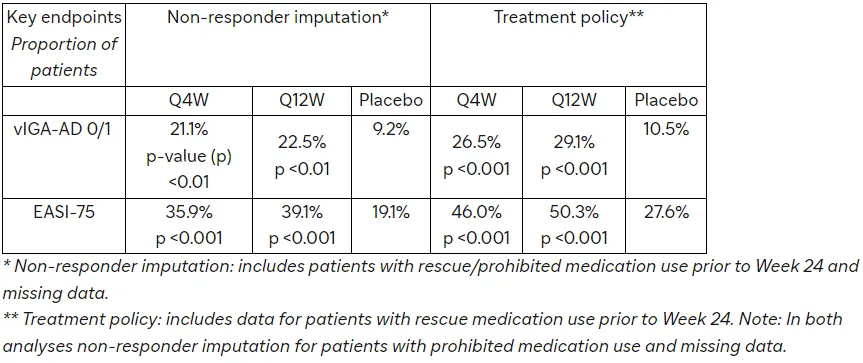
对于美国及其参考国家,主要终点为患者在特应性皮炎验证性研究者总体评估量表(vIGA-AD)中评分为0(皮肤清除)或1(几乎清除),且较基线下降≥2分的比例。对于欧洲、欧洲参考国家及日本,共同主要终点包括vIGA-AD评分为0/1且较基线下降≥2分的患者比例,以及湿疹面积与严重指数总评分(EASI-75)改善≥75%的患者比例。
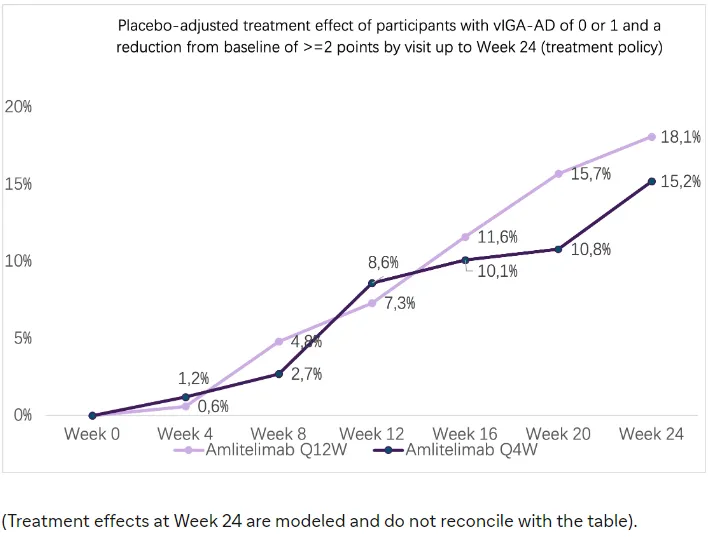
此外,在两个给药组中,疗效在整个治疗期间持续增加,未出现平台期。
在第24周,研究的关键次要终点在两个给药方案中均得到实现,包括:达到vIGA-AD评分0/1且仅有轻微红斑,同时较基线下降≥2分的患者比例,以及在基线PP-NRS评分≥4的患者中,瘙痒峰值评分较基线下降≥4分的患者比例。
在COAST 1研究中(任一给药组≥5%发生率),最常见的治疗相关不良事件(TEAEs)为特应性皮炎、鼻咽炎及上呼吸道感染,其中均在安慰剂组发生率高于Amlitelimab治疗组。注射部位反应在Amlitelimab组出现率略高(Amlitelimab合并组2.2%,安慰剂组0.7%),均为轻度,患者均可恢复,且治疗过程中无需中断用药。发热发生率为Amlitelimab合并组1.1%,安慰剂组0.7%;寒战发生率为Amlitelimab合并组0.4%,安慰剂组0%。总体而言,治疗相关不良事件(TEAEs)、严重不良事件以及因不良事件导致的停药率在Amlitelimab组与安慰剂组相似。
完整研究结果将提交于即将召开的医学会议进行展示。
Sanofi研发执行副总裁Houman Ashrafian表示:“Amlitelimab首次Ⅲ期研究的积极结果进一步验证了靶向OX40配体(OX40L)调节过度活跃免疫系统的潜力,而无需耗竭T细胞。这可能代表特应性皮炎治疗的重大进展,具有逐步增强的疗效和每年仅需给药四次的潜力。”