转铁蛋白受体1(TfR1),又称分化簇71(CD71),是一种与转铁蛋白(Tf)结合的II型跨膜糖蛋白,通过与铁结合的Tf相互作用,在细胞摄取铁的过程中发挥重要作用。
TfR1在恶性肿瘤细胞上的表达水平升高,加上其细胞外可及性、内化能力和在癌细胞病理中的重要作用,使得该受体成为抗体介导治疗的潜在靶点。
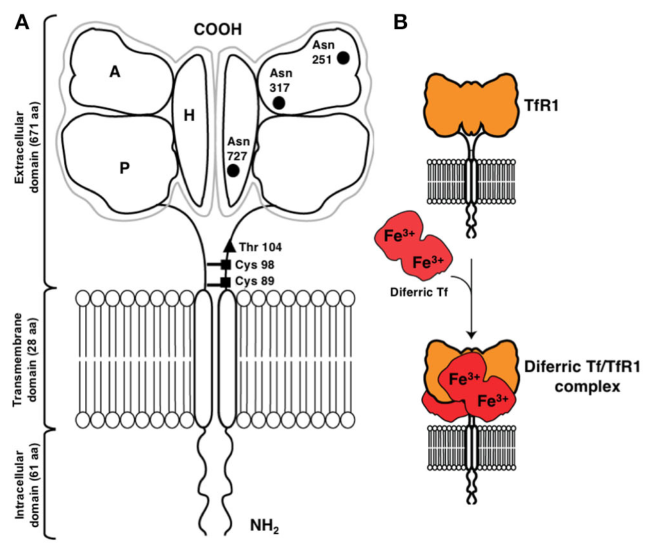
TfR1的结构
TfR1是一种与转铁蛋白(Tf)结合的II型跨膜糖蛋白,由760个氨基酸组成,以二聚体的形式存在,通过二硫键连接。TfR1由胞外C末端结构域(671个氨基酸)、跨膜区(28个氨基酸)和胞内N末端结构域(61个氨基酸)组成。C端胞外区在251、317和727处的天冬酰胺残基处包含三个N连接的糖基化位点,在104处的苏氨酸残基处包含一个O连接的糖基化位点,这些都是TfR1受体充分发挥功能所必需的。
Tf由679个氨基酸组成的多肽链和两个碳水化合物链组成,由两个40 kDa的亚基组成,中间由一个短连接序列隔开,每个亚基能够结合一个游离的铁离子(Fe3+),因此,Tf最多可以结合两个铁离子,并通过与TfR1的相互作用将Fe3+输送到细胞表面进行内化。
TfR1的结构及配体[1]
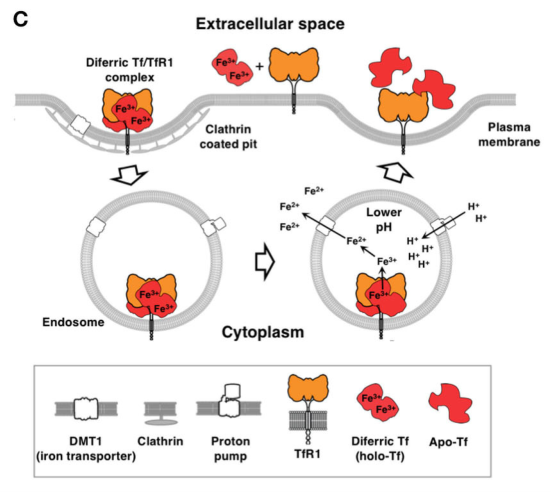
TfR1的功能
细胞内吞作用将铁离子与Tf/TfR1复合体输送到内吞体内,在内体中,由内体膜质子泵介导的质子(H+)内流导致pH降至5.5(内体酸化),从而触发Tf和TfR1的构象变化,导致随后从Tf释放铁离子。然后,铁离子被铁还原酶STEAP3从Fe3+转化为Fe2+,并由二价金属转运蛋白1(DMT1)从内体中泵出。然后,Tf/TfR1复合体被循环回到细胞表面。细胞质中的Fe2+被结合到血红素和各种酶中,作为辅助因子驱动许多关键的细胞过程。
细胞通过内吞作用摄取铁[1]
TfR1的表达
一般来说,TfR1在大多数正常细胞上都有低水平的表达。在高增殖率的细胞上表达增加,包括基底表皮、肠上皮和某些激活的免疫细胞。在胎盘滋养层细胞和红系祖细胞等对铁需求较高的细胞上也观察到高表达。
由于大多数癌细胞的高增殖率,TfR1在恶性肿瘤细胞上过度表达,与正常细胞相比,恶性肿瘤细胞的生长更依赖铁,这种现象被称为“铁瘾”。因此,癌细胞对缺铁更敏感。
TfR1已被确定为一种通用的癌症标记物。在许多癌症中,TfR1的高表达与晚期和/或预后较差有关,包括乳腺癌、卵巢癌和肺癌等实体癌,慢性淋巴细胞白血病(CLL)等血液瘤。
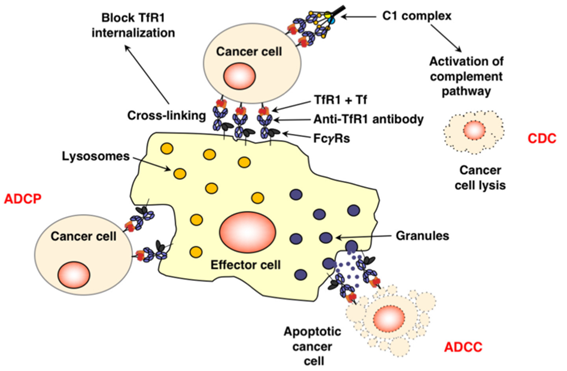
靶向TfR1用于癌症治疗
TfR1可以通过两种不同的方式作为肿瘤治疗的靶点:
1)间接使用Tf、铁蛋白或针对TfR1的抗体来递送抗癌药物:包括递送化药、蛋白质(如毒素)、核酸(如寡核苷酸)和病毒载体。还可以生产针对TfR1的纳米药物和其他制剂,例如ADC或PDC。
2)利用抗体本身作为抗癌药物,利用抗体直接抑制TfR1功能或激活抗体介导的效应功能,如ADCC、ADCP和CDC。
重要的是,TfR1用于癌症治疗的两种方式并不是相互排斥的。直接具有细胞毒性的抗体也可用于递送目的。
Fc介导的抗TfR1抗体的功能[1]
用心做好细胞,为更好的靶向药
吉满生物根据市场需求和研究现状,推出构建CD71过表达稳定细胞系/抗体的服务,充分满足药物研发需求,助力抗体药物临床申报。点击此处了解产品
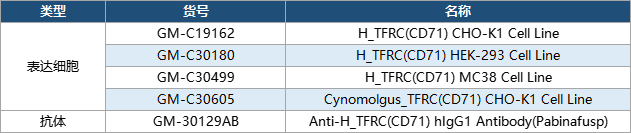
产品列表
数据展示
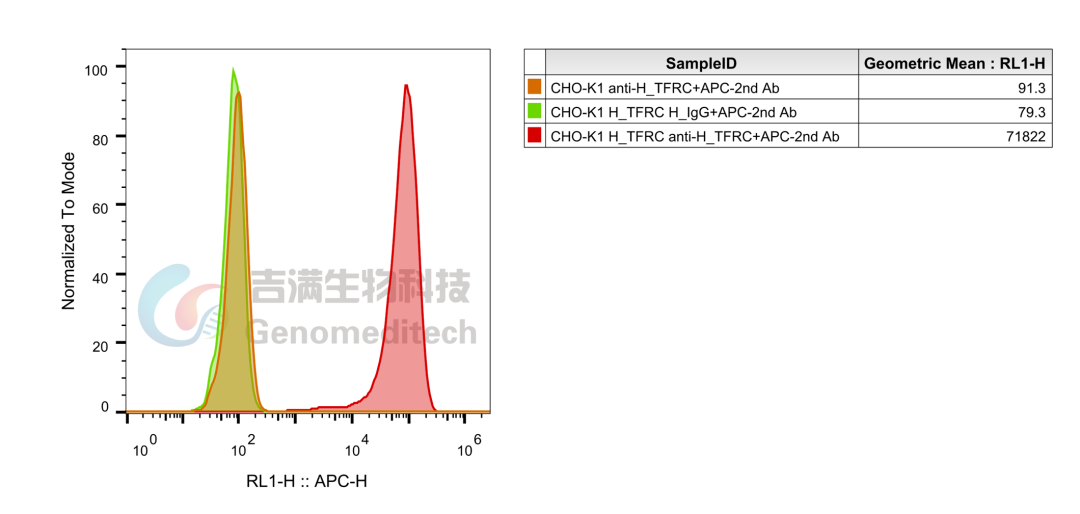
H_TFRC(CD71) CHO-K1 Cell Line(Genomeditech/GM-C19162)使用Anti-H_TFRC(CD71)hIgG1 Antibody(Pabinafusp)(Genomeditech/GM-30129AB),流式结果
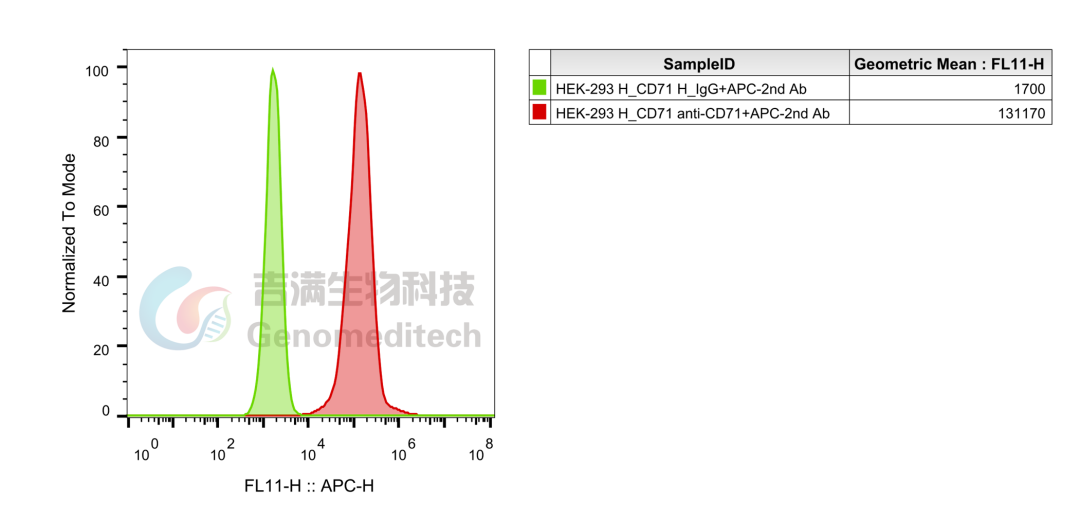
H_TFRC(CD71) HEK-293 Cell Line(Genomeditech/GM-C30180)使用Anti-H_TFRC(CD71)hIgG1 Antibody(Pabinafusp)(Genomeditech/GM-30129AB),流式结果
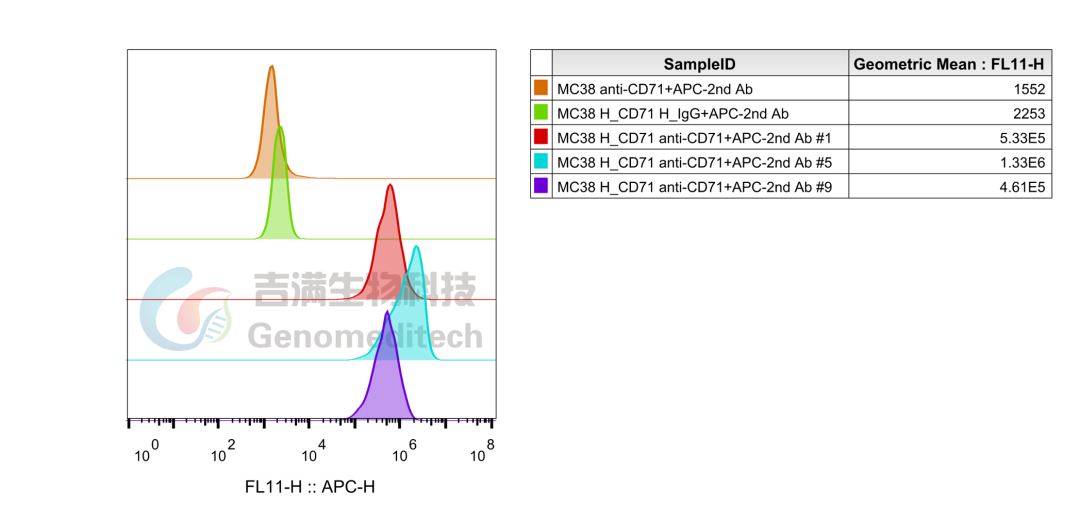
H_TFRC(CD71) MC38 Cell Line(Genomeditech/GM-C30499)使用Anti-H_TFRC(CD71)hIgG1 Antibody(Pabinafusp)(Genomeditech/GM-30129AB),流式结果
参考:
[1]doi: 10.3389/fimmu.2021.607692