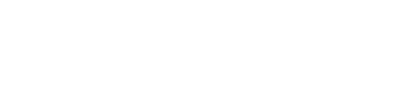研究背景
动脉粥样硬化是糖尿病的大血管并发症之一,糖尿病是动脉粥样硬化疾病发生发展的主要危险因素。越来越多的研究表明,内皮细胞(ECs)中的氧化应激和炎症反应是糖尿病相关并发症发病机制的核心角色。因此可以通过靶向内皮氧化应激,以降低内皮功能障碍,从而糖尿病加速动脉粥样硬化。
Nrf2是一种内源性抗氧化剂,对氧化应激相关疾病具有巨大的治疗作用。正常状态下,Nrf 2与Keapl识别并形成聚合物,其作用会被Keap 1抑制;在氧化应激等状态下,Nrf 2与Keap解离被激活,并进入细胞核与抗氧化反应元件(ARE)结合,导致几种抗氧化蛋白(如血红素加氧酶HO-1)的表达。在氧化应激过程中,烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)被描述为活性氧(ROS)产生的主要来源。
NOX2被认为是心血管细胞中ROS的主要来源,其中p47phox的磷酸化是NOX2复合物组装和该酶激活的关键步骤。有趣的是,细胞质p47phox在物理上与Nrf2结合,增加Nrf2的核积累,导致Nrf2依赖的基因的上调。也就是说,通过破坏Keap1/Nrf2复合物和增强p47phox/Nrf2复合物来激活Nrf2通路可能是预防和治疗糖尿病相关并发症,如动脉粥样硬化的一种前瞻性方法。
文献来源
近日,中国药科大学药学院孙海建课题组等人在Cell Death & Disease发表 “A dual Keap1 and p47phox inhibitor Ginsenoside Rb1 ameliorates high glucose/ox-LDL-induced endothelial cell injury and atherosclerosis”的研究性论文,作者报道了人参皂苷Rb1在抑制Keap1和p47phox荧光素酶报告基因活性方面具有双重作用,并阐明了Rb1预处理对内皮细胞(ECs)损伤的保护作用及其分子机制。
Rb1预处理对内皮细胞(ECs)保护作用
利用379种天然产物的荧光素酶报告基因分析,作者报道了人参皂苷Rb1在Keap1和p47phox荧光素酶报告基因活性方面发挥了双重抑制作用。随后,用不同浓度的Rb1预处理EA.hy926细胞30分钟,然后ox-LDL/HG处理24小时达到诱导动脉粥硬化的目的,结果显示Rb1预处理增强了EA.hy926内皮细胞活力,降低了氧化应激、炎症、内皮-间充质转化(EndMT)和凋亡,并改善了氧化低密度脂蛋白(ox-LDL)加高糖(HG)刺激后的线粒体质量。
Rb1直接与Keap1结合并促进其降解
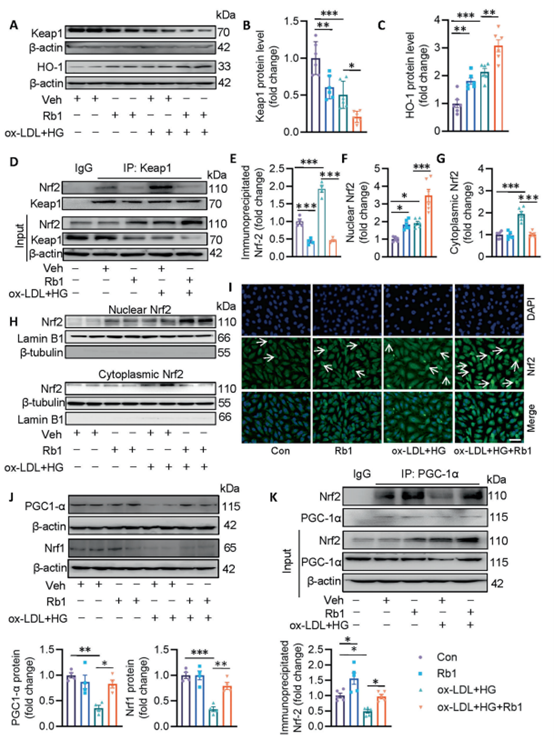
分子对接分析找到了Rb1和Keap1结合的2个作用位点(包含Tyr525、Ser508、Arg415、Asp573、Val467),结合表面等离子体共振(SPR)和微尺度热电泳(MST)结果揭示了Rb1与Keap1的潜在相互作用。在Keap1的Tyr525,Ser508,Arg415,Asp573和Val467残基突变为丙氨酸后,Rb1在ox-LDL/hg培养的细胞中,Rb1的抗氧化和线粒体保护作用显著减弱。在ox-LDL/HG的存在下,Keap1蛋白减少,而Nrf2下游靶基因HO-1蛋白增加,可能是对氧化应激的适应性反应,而Rb1进一步增强了这种反应,提示Rb1可能通过抑制Keap1成为Nrf2的潜在激活因子。通过COIP实验进一步表明Rb1降低了ox-LDL/HG暴露的ECs中Nrf2/Keap1的相互作用。
针对核质提取物的蛋白分析显示,Rb1促进了Nrf2在ECs中的核积累,免疫荧光与此一致,Rb1处理的EC细胞中Nrf2的核染色更多。此外,许多转录因子和转录共激活因子参与了线粒体的生物发生,包括Nrf1、Nrf2和PGC-1α,检测结果显示ox-LDL/HG降低了PGC-1α和Nrf1的蛋白表达,而Rb1预处理则挽救了这些蛋白的表达,并且Rb1有助于增强PGC-1α/Nrf2的结合。这说明了通过Nrf2激活促进线粒体生物发生是Rb1保护线粒体完整性免受ox-LDL/HG损伤的另一种方式。然而,利用si-Nrf2和si-PGC-1α消除了Rb1介导的保护作用。
(Rb1促进Nrf2与Keap1的解离,并诱导Nrf2与PGC-1α的相互作用)
SYVN1被鉴定为Keap1的E3连接酶
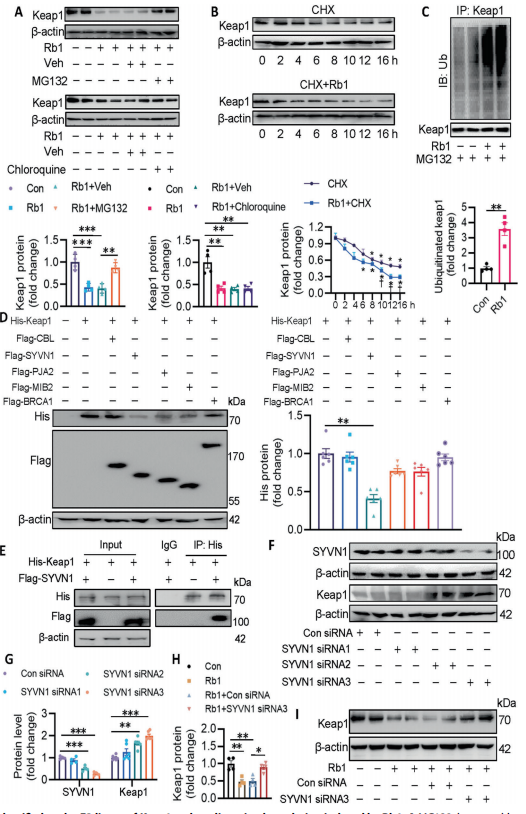
作者进一步研究了Rb1是否在翻译后修饰水平调控Keap1的表达。用MG132蛋白酶体抑制剂处理后,逆转了Rb1对Keap1蛋白水平的影响,而氯喹处理无变化,即Rb1通过蛋白酶体降解破坏了Keap1的稳定性。其次,Rb1在CHX的存在下加速了Keap1的降解,加速了Keap1的泛素化。利用生信预测筛选了导致keap1蛋白酶体降解E3连接酶的5个候选分子(CBL、SYVN1、PJA2、MIB2和BRCA1),只有SYVN1过表达导致Keap1蛋白显著降低。采用免疫共沉淀法检测到Keap1与SYVN1存在直接相互作用,且si-SYVN1 阻断了Rb1对EC中Keap1蛋白水平的抑制作用。以上结果表明SYVN1是Keap1的真正E3连接酶。
(SYVN1被鉴定为Keap1的E3连接酶,介导Rb1诱导的其降解)
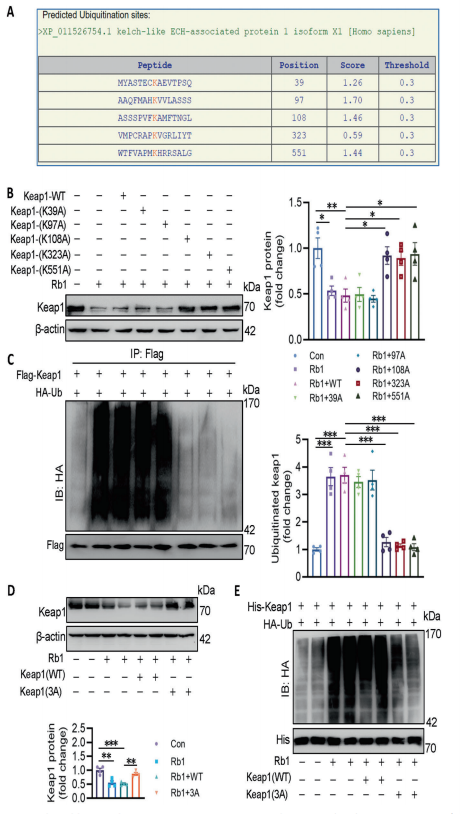
Rb1促进syvn1介导的Keap1在K108、K323和K551位点的泛素化
使用BDM-PUB数据库(http://bdmpub.biocuckoo.org/podece.php)预测有5个赖氨酸残基是Keap1的泛素化位点,当K108、K323和K551突变为丙氨酸时,Rb1对Keap1的降解和泛素化作用减弱,同时突变后Rb11诱导的Keap1蛋白酶体降解具有抗性。到此可以得出,Rb1促进syvn1介导的Keap1在K108、K323和K551位点的泛素化,导致Keap1蛋白降解。
(Rb1促进syvn1介导的keap1 在K108、K323和K551处的泛素化)
Rb1直接与p47phox结合并增强其去磷酸化
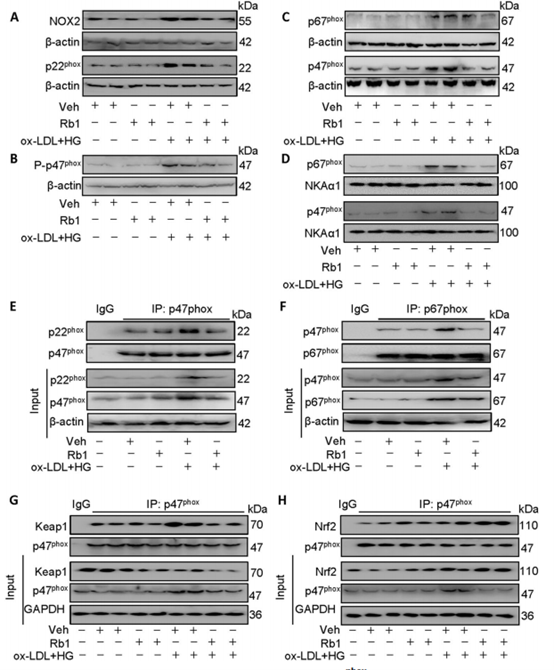
鉴于Rb1对p47phox荧光素酶报告基因的抑制作用,Rb1与p47phox之间是否存在直接的相互作用,展开了部分研究。通过分子对接分析表明Rb1与p47phox存在结合作用。Rb1预处理可逆转ox-LDL/hg暴露下NOX2和p22phox蛋白表达水平的升高,降低了p47phox、总p47phox的磷酸化水平,但不改变总p67phox的磷酸化水平。
免疫沉淀显示Rb1预处理阻止了ox-LDL/HG诱导的p47phox/p22phox复合物和p47phox/p67phox复合物的形成,表明Rb1可能是NOX2的潜在抑制剂。Rb1的预处理破坏了Keap1与ox-LDL/HG诱导的p47phox的关联,但导致在ox-LDL/HG环境中,p47phox与Nrf2的相互作用增加。本部分得出Rb1直接与p47phox结合并增强其去磷酸化,增加了p47phox与Nrf2的相互作用。
(Rb1增强了p47phox的去磷酸化和细胞质丰度,并促进了p47phox和Nrf2的相互作用)
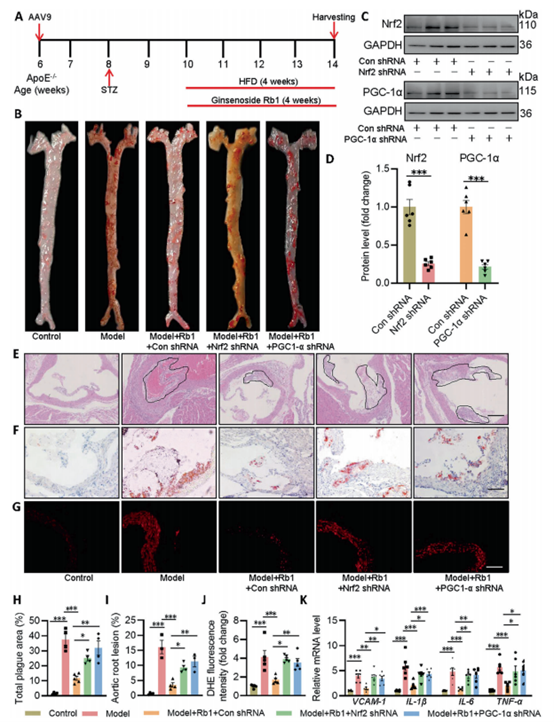
Rb1可保护糖尿病ApoE−/−小鼠的动脉粥样硬化病变
在动物实验中,作者通过尾静脉注射Tie-Nrf2 shRNA,Tie-PGC-1α shRNA(AAV9,5 × 1011 viral particles, Genomeditech)和对照腺相关病毒,取样检测,发现与糖尿病ApoE−/−小鼠相比,Rb1处理后的小鼠主动脉动脉粥样硬化病变大受抑制,Nrf2或PGC-1α缺失后,Rb1并不能减弱动脉粥样硬化斑块的形成。主动脉根部的H&E染色和Oil O Red染色也检测到类似的结果,主动脉切片DHE染色显示,糖尿病动脉粥样硬化小鼠超氧阴离子的产生增加,而Rb1治疗的抑制作用依赖于Nrf2和PGC-1α的存;糖尿病性ApoE−/−小鼠内皮细胞中促炎因子VCAM-1、IL-1β、IL-6、TNF-α的含量明显升高,经Rb1处理后被清除。内皮细胞中Nrf2或PGC-1α的特异性缺失消除了Rb1在模型小鼠主动脉中的抗炎作用。
(Nrf2和PGC-1α是Rb1改善糖尿病加速动脉粥样硬化所必需的)
综上所述,在内皮细胞(ECs)中,Rb1预处理增强了细胞活力,降低了氧化应激、炎症、内皮-间充质转化(EndMT)和凋亡,并改善了氧化低密度脂蛋白(ox-LDL)加高糖(HG)刺激后的线粒体质量。Rb1通过招募SYVN1,通过赖氨酸残基(K108,K323,K323和K551)促进其泛素化和蛋白酶体降解,导致Nrf2从Keap1解离,Nrf2核易位,Nrf2/PGC-1α复合体形成。进一步发现,Rb1可以与p47phox结合,降低其磷酸化和膜易位,从而破坏NOX2复合物的组装。更重要的是,Rb1介导的细胞质p47phox的保存稳定并有助于Nrf2的激活。此外,在链脲佐菌素(STZ)诱导的ApoE−/−小鼠中,Rb1减少了主动脉粥样硬化斑块的形成,并减少了氧化应激和炎症反应,但在Nrf2和PGC-1α缺乏的ApoE−/−小鼠中没有。总之,本文证明了直接靶向Rb1的Keap1和p47phox,可能是治疗糖尿病动脉粥样硬化的一个有吸引力的候选药物。
吉满助力
本研究中所用报告基因质粒PGL3-basic-HKeap1 luciferase reporter gene plasmids,PGL3-basic-H-p47phox luciferase reporter gene plasmids和腺相关病毒GPAAV-tie-eGFP-5’mir30-Mouse-Nfe2l2(Nrf2)-shRNA3-3’mir30-tie enhancer CW3SL and GPAAV-tie-eGFP-5’mir30-MousePpargc1a(PGC1-α)-shRNA3-3’mir30-tie enhancer CW3SL 均由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官方网站:www.genomeditech.com
免费咨询电话:400-627-9288