12月4日,君实生物2025 ESMO Asia 官网更新了其CLDN18.2 ADC药物JS107,联合PD-1药物toripalimab及化疗在晚期胃癌/胃食管交界处腺癌一线治疗的最新研究进展。
图源:2025 ESMO Asia 官网
JS107是一款以单甲基澳瑞他汀E为有效载荷的CLDN18.2特异性抗体偶联药物(ADC)。点击了解CLDN18.2相关产品
本文基于其I期临床试验(NCT05502393)数据,更新JS107联合托瑞帕利单抗及化疗作为晚期胃癌/胃食管交界处癌(G/GEJA)一线治疗的疗效与安全性。
方法
此项联合治疗研究包含剂量递增阶段(JS107剂量2.0-3.0 mg/kg,每3周给药1次)和扩展阶段(JS107剂量2.0 mg/kg,每3周给药1次)。入组标准为CLDN18.2阳性(定义为≥1%肿瘤细胞呈≥1+染色强度)、HER2阴性、既往未接受治疗的晚期胃癌/胃食管交界处癌患者,接受JS107联合托瑞帕利单抗(240 mg Q3W)及全剂量XELOX方案(卡培他滨1000 mg/m2 BID, D1-D14)及奥沙利铂130 mg/m²(D1,每3周1次)方案,或75%全剂量XELOX方案。主要终点为安全性。
结果
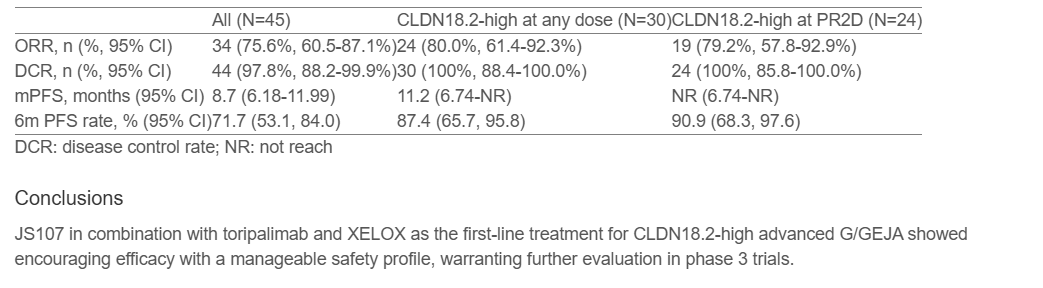
截至2025年9月28日,共入组45例患者(剂量递增期9例,剂量扩展期36例)。中位随访时间为8.3个月。推荐的II期剂量(RP2D)确定为JS107 2.0 mg/kg联合托瑞帕利单抗及75%剂量XELOX方案。
57.8%的患者出现≥3级治疗相关不良事件,最常见为中性粒细胞减少症(20.0%)。疗效数据见表,显示与CLDN18.2表达水平呈正相关。
在CLDN18.2高表达(定义为≥40%肿瘤细胞呈≥2+染色强度)的胃/胃食管交界部癌患者中,RP2D治疗组客观缓解率(ORR)达79.2%,中位无进展生存期(PFS)尚未达到。
结论
JS107联合托瑞帕利单抗和XELOX方案作为CLDN18.2高表达晚期胃癌/胃食管交界部癌的首选治疗方案,展现出令人鼓舞的疗效且安全性可控,值得在III期临床试验中进一步评估。