研究背景
肝癌是全球癌症死亡的第三大原因,肝细胞癌(HCC)占大多数病例。高达60%局部可切除的患者在诊断后5年仍然存活,而远处转移的患者只有4%。由于转移在很大程度上仍无法治愈,了解这一过程对于改善晚期HCC患者的预后很重要。
目前,几项大规模的测序工作为驱动HCC发病机制的关键遗传和转录过程提供了有价值的见解。然而,大多数分析都是针对原发性HCC进行的。虽然转移性肿瘤与原发肿瘤具有共同的关键驱动基因改变或转录程序,但它们在传播和治疗过程中往往会发展出新的性状。随着高度异质性的原发病变和可能更均匀的转移的演变,迫切需要通过测序匹配的原发和转移肿瘤获得转移性疾病的全面遗传和分子景观,以阐明生物学基础并确定更有效的HCC转移治疗策略。
文献来源
2023年12月14日,复旦大学(附属中山医院)肝癌研究所樊嘉院士团队与上海科技大学张力烨团队合作在国际顶尖肿瘤学期刊Cancer Cell上发表题为“Integrated multi-omics profiling to dissect the spatiotemporal evolution of metastatic hepatocellular carcinoma”的研究性论文。
本研究基于多组学平台,整合分析多组学数据,在国际上首次系统刻画了肝癌转移的时空演进全景图谱,揭示了肝癌转移的复杂进化轨迹和克隆选择机制,为研发肝癌转移预测的新标志物和治疗新靶点提供了宝贵的数据和理论基础。
研究结果
Graphical abstract 图形概要
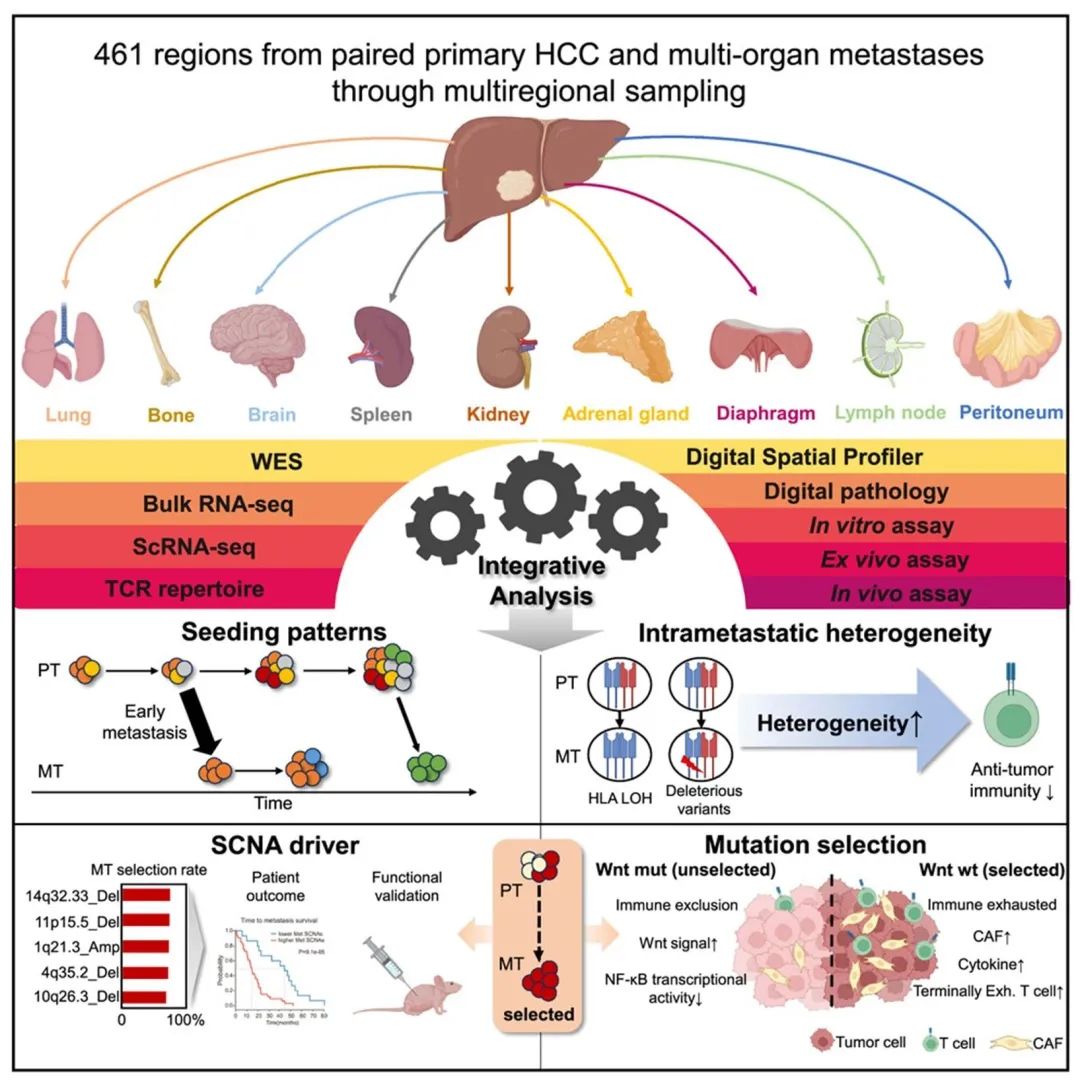
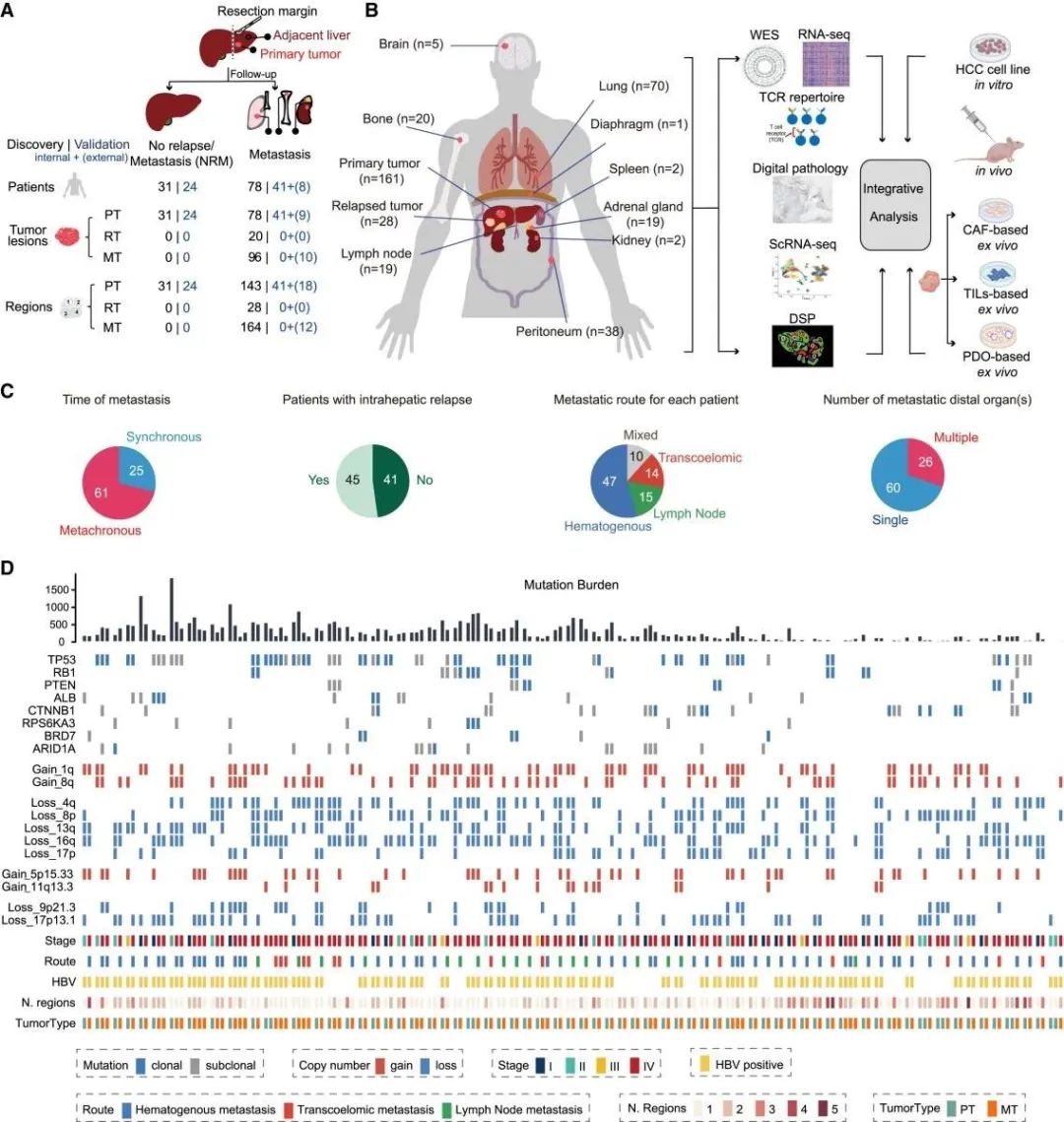
该研究对182例HCC患者的257个原发区和176个转移区进行了多组学分析,肝外转移肿瘤(MTs)中观察到的高频率突变和SCNA的队列和以前研究中的原发肿瘤(PTs)高度一致(图1)。
图1 HCC转移队列概述
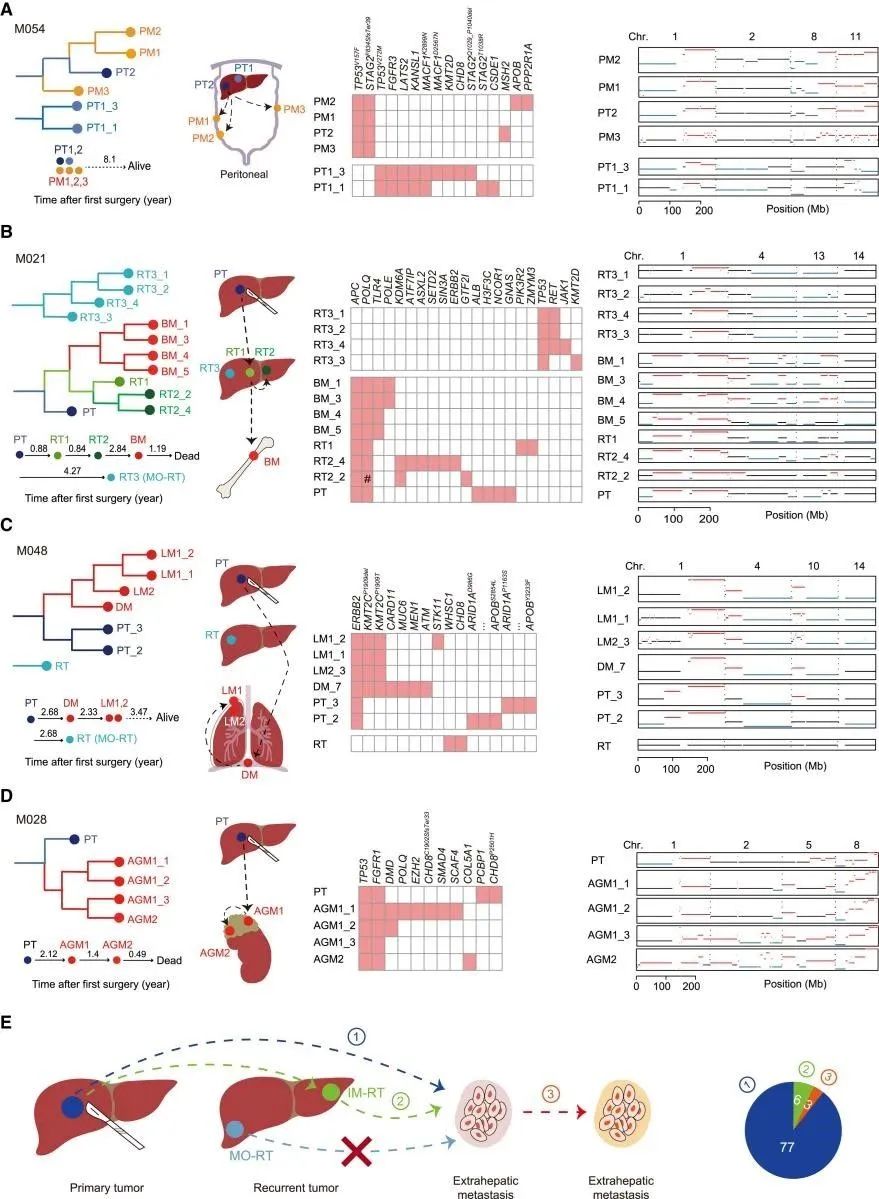
为了追踪MTs的克隆起源,研究人员使用Treeomics重建了同一患者内所有已测序肿瘤的系统发育和PTI。在HCC中,RTs可分为遗传上相似的肝内转移(IM)和遗传上不同的多中心发生(MO)。结果表明,MO-RT谱系转移能力弱于IM-RT谱系,这与MO-RT较好的预后一致。综上所述,肝外转移是以单系方式进行的(图2)。
图2 追踪转移的起源
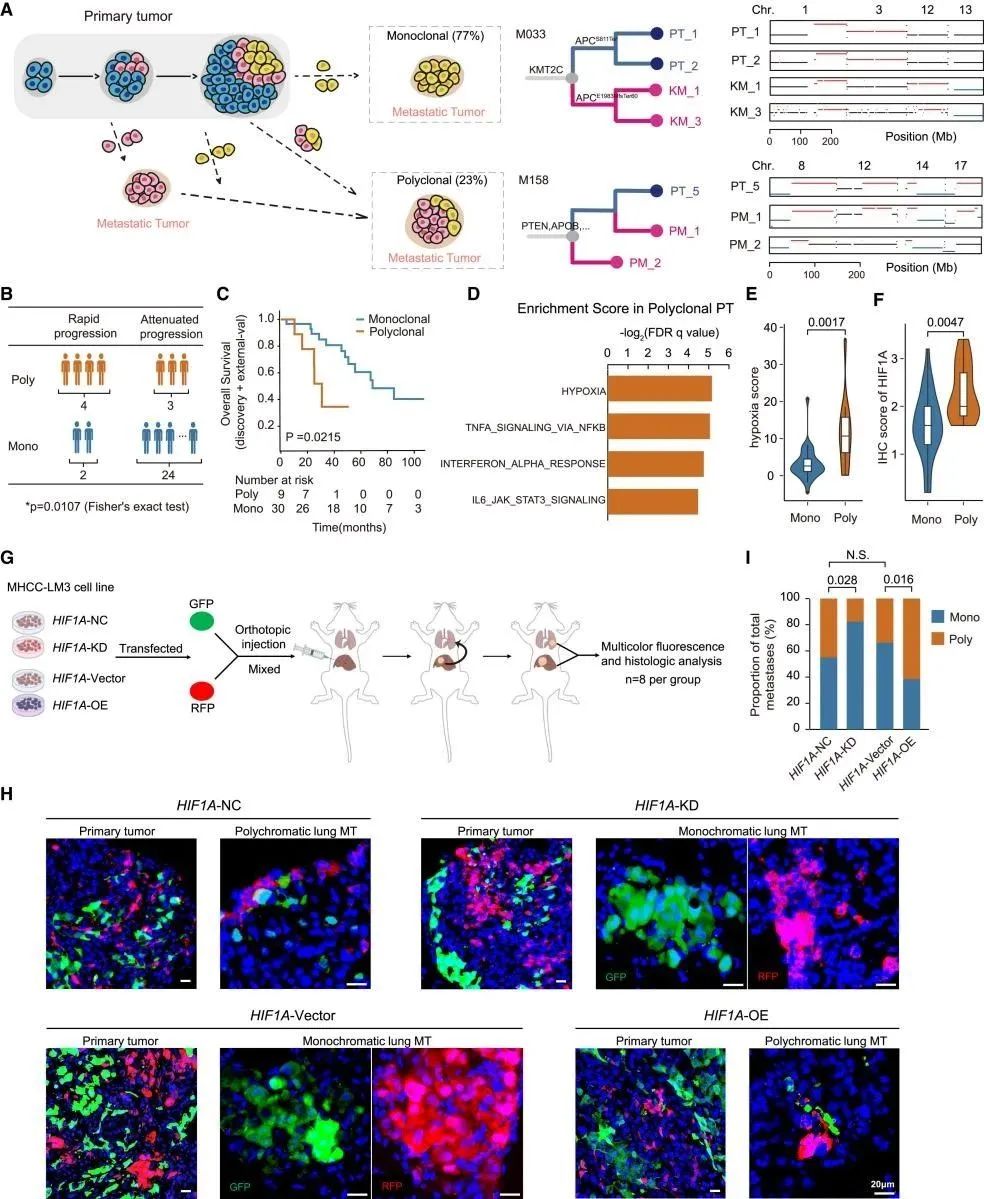
癌症转移可以通过单个亚克隆(单克隆播种)或多个不同的亚克隆(多克隆播种)进行播种。33例患者术后发生异时性转移,进一步分为两个亚组:快速进展或衰减进展。基因集富集分析(GSEA)强调了多克隆接种的PTs中缺氧信号的转录激活(图3D)。同时,通过HIF1A 敲低(KD)和过表达(OE)的细胞进行(图3G-I)肺转移分析,结果发现多克隆接种与较差的预后相关,缺氧可能导致HCC的多克隆传播。
图3 多克隆转移与生存率低相关
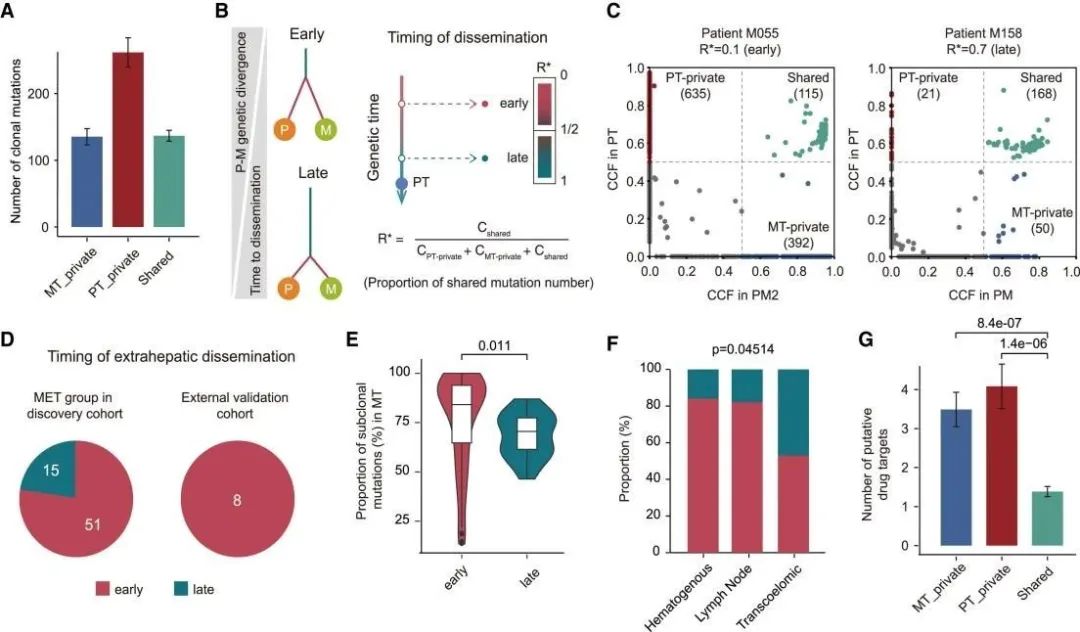
越来越多的证据表明,转移性播散可能在多种癌症类型的早期开始。为了模拟转移扩散的时间顺序,研究人员开发了一个基于配对PT和MT之间基因组异质性程度的模型(图4B)。结果发现在转移性克隆的早期传播后,PT-private和MT-private亚克隆突变继续积累,导致PT和MT之间的遗传谱不同(图4)。
图4 转移扩散的时间
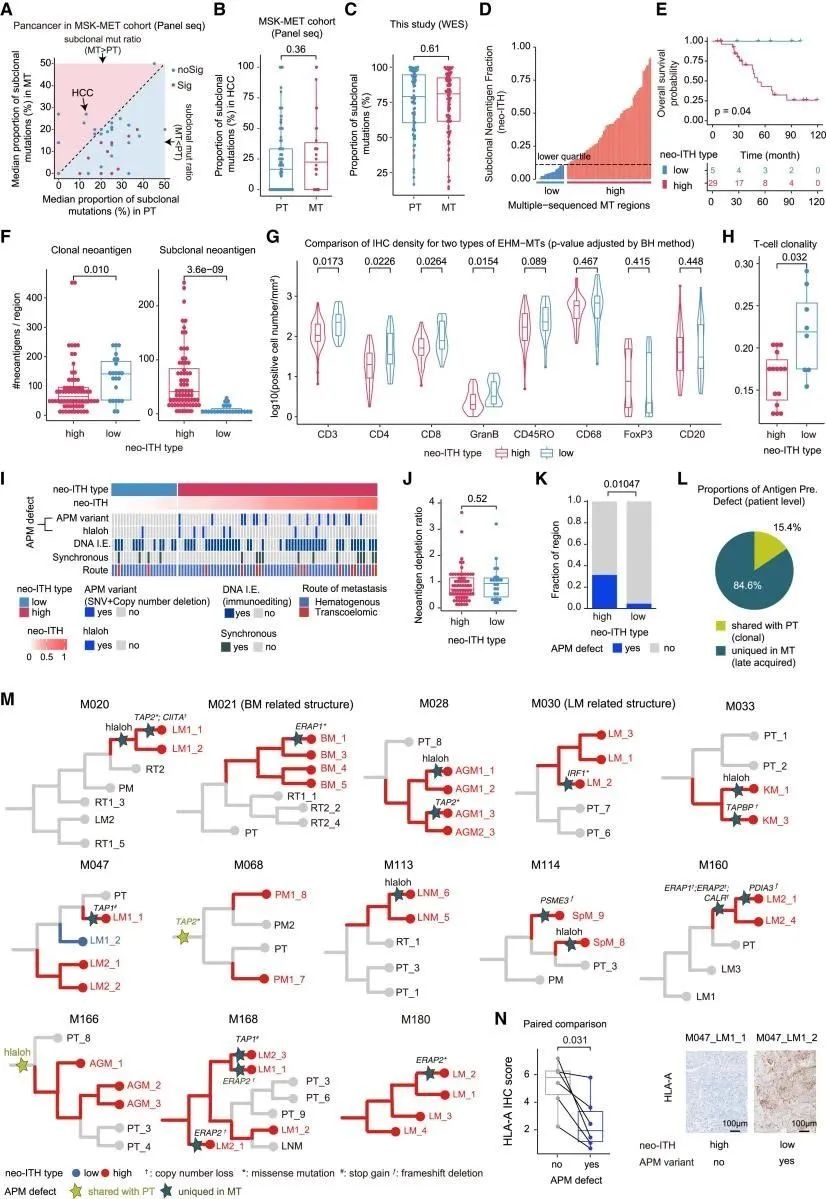
在转移瘤中观察到的显着的肿瘤内新抗原异质性与新抗原呈递中断导致的T细胞反应性降低有关。这可能归因于新抗原耗竭或抗原加工和呈递机制(APM)的破坏。通过发生区域的绘制,量化每个转移区域的DNA免疫编辑程度,评估APM缺陷来源,MTs在HCC中表现出更高水平的转移性异质性。高新抗原ITH MT在转移定植后随着新抗原呈递功能障碍而进化,这可能会损害抗肿瘤T细胞免疫并导致不良临床结局(图5)。
图5 转移内异质性的表征
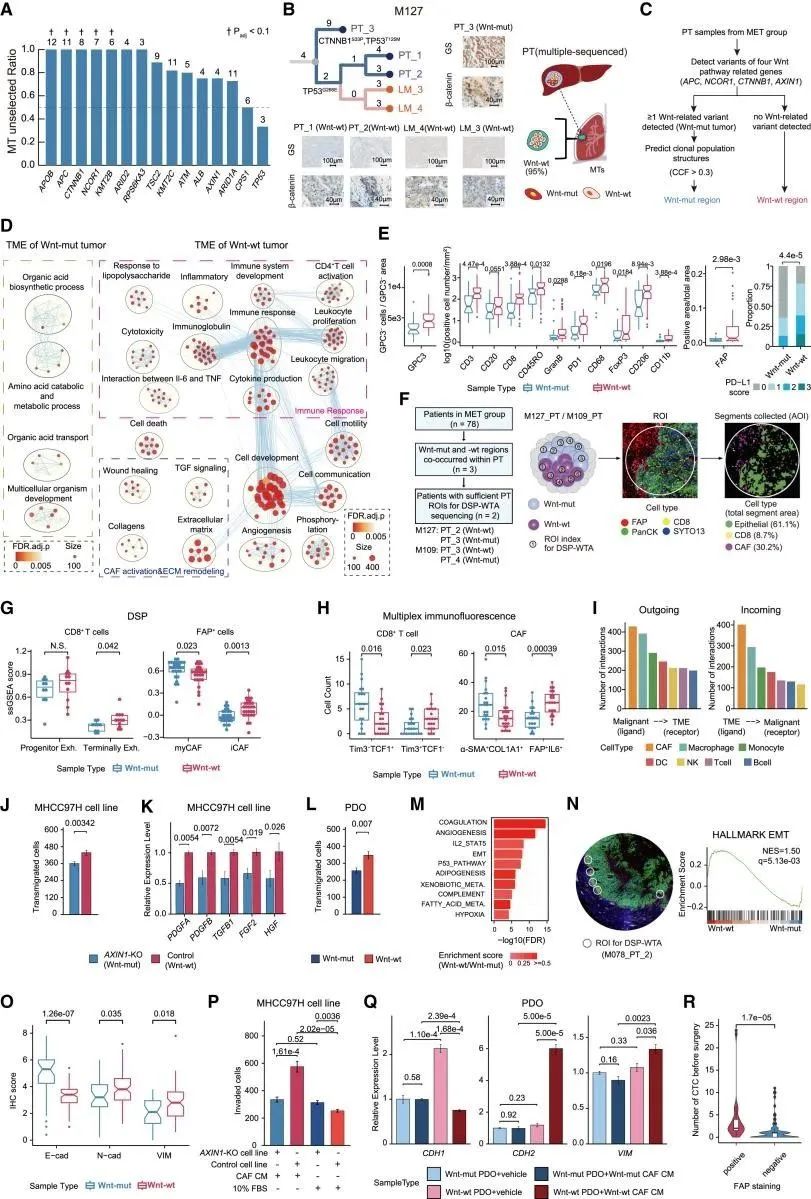
研究人员将体细胞拷贝数改变视为驱动转移的高度选择性事件。与具有Wnt突变的亚克隆相比,没有Wnt突变的亚克隆显示出更强的转移选择性优势,其特征在于富含有利于促转移表型的活化成纤维细胞的微环境。Wnt-wt HCC区域似乎含有富含活化成纤维细胞的反应性TME,通过激活EMT程序赋予Wnt-wt癌细胞更强的转移传播能力(图6)。
图6 Wnt通路基因的亚克隆突变在转移中未被选择
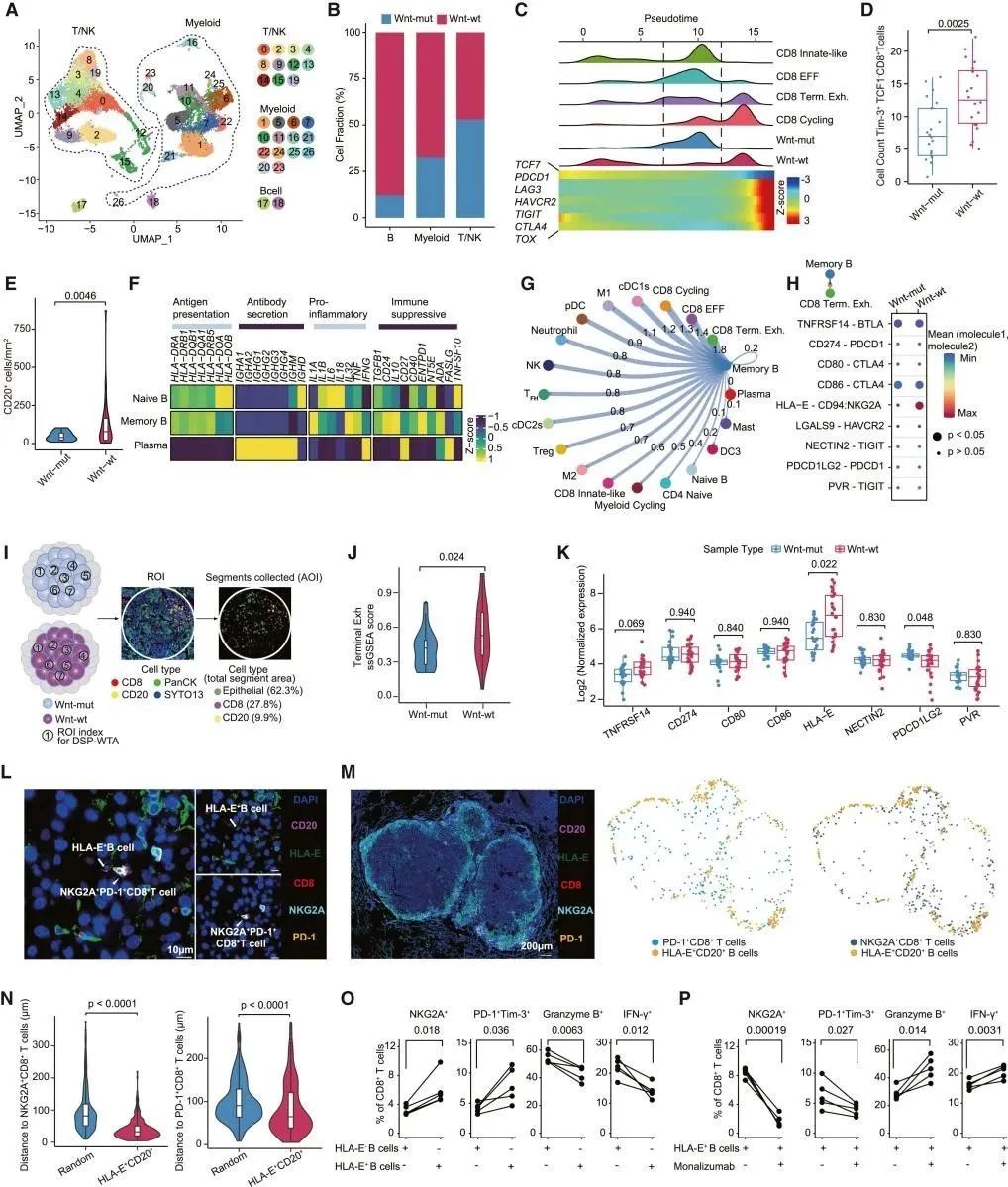
为了进一步解释Wnt-mut和Wnt-wt MT之间的免疫生态系统差异,研究人员对新鲜手术转移性HCC样本的CD45+细胞进行了scRNA-seq分析,结果发现,Wnt-wt MTs表现出免疫抑制B细胞的浸润增加,通过HLA-E:CD94-NKG2A相互作用导致CD8+ TILLs末端衰竭。这些发现突出了靶向这种相互作用作为转移性HCC治疗策略的潜力(图7)。
图7 Wnt-wt和Wnt-mut MT免疫生态系统的差异
总的来说,这项研究结果提供了转移复杂进化过程的多维剖析,揭示了肝细胞癌肿瘤转移的复杂演化过程。这项研究可以成为一项宝贵的资源,为HCC转移进展的进化动力学提供重要的见解,并为晚期HCC患者开发预测性生物标志物和治疗靶点提供合理的基础。
吉满助力
本研究中所用的HIF1a过表达及干扰细胞株,AXIN1-knockout MHCC97H敲除细胞系均由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288
文献来源
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00401-4
声明:此推文仅代表作者个人观点,如有不科学之处,联系小编敬请指正!