研究背景
由创伤、感染、肿瘤切除和骨骼异常引起的骨缺损的再生是颌面外科面临的重大挑战之一。
使用不同的骨替代物进行移植已经变得越来越普遍,但因血管化不足造成了有限的祖细胞分化和缺血性坏死的发生,进而导致延迟愈合,甚至不愈合的情况。
骨损伤后,骨髓间充质干细胞(MSCs)可成骨分化为功能性骨细胞形成新骨。成骨分化需要持续活跃的代谢来满足能量需求。此外,骨损伤引起的微循环破坏会导致严重的缺氧微环境,缺氧诱导因子HIF-1α可激活诱导成骨细胞的代谢重编程,从有氧呼吸向无氧糖酵解转移,增强缺氧微环境中细胞的存活。
在骨骼系统中,HIF-1α在H型毛细血管形成中起着至关重要的作用,可促进血管生成和成骨耦合。
文献来源
安徽医科大学口腔医学院徐建光副教授、王元银教授联合首都医科大学周建教授课题组在《Bioactive Materials》上发表题为“ETV2 regulating PHD2-HIF-1α axis controls metabolism reprogramming promotes vascularized bone regeneration”的研究性论文。
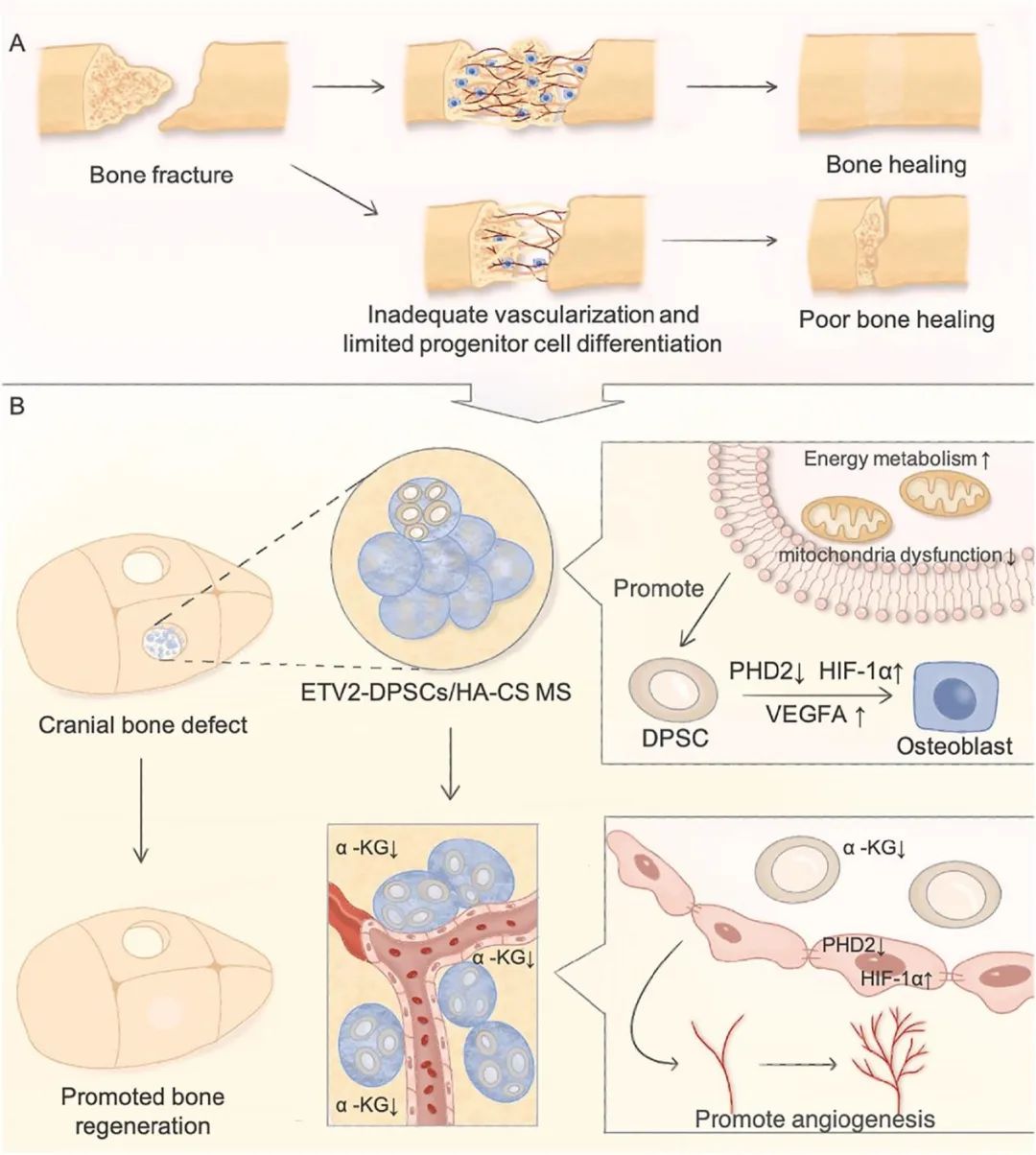
研究以MSCs为重点,揭示了ETV2调节细胞内HIF-1α稳态,并影响骨生态位内的缺氧信号,从而加速血管化骨再生。
项目研究
ETS变体2(ETV 2)是一种转录因子,能促进能量代谢重编程,并协调骨生成和血管生成之间的关系。具体来说,ETV2通过靶向抑制PHD2和促进ERK1/2磷酸化来促进DPSCs中HIF-1α的稳定和功能激活,并通过调控PHD 2-HIF-1α-VEGFA轴促进牙髓干细胞(DPSCs)向成骨细胞分化。
值得注意的是,ETV 2同时通过加速线粒体有氧呼吸和糖酵解来实现能量代谢的快速重新编程,从而满足加速成骨分化所必需的能量需求。ETV 2修饰的DPSCs释放的α-KG减少有助于微循环重建。
此外,研究人员利用具有仿生纳米结构的羟基磷灰石/壳聚糖微球(HA/CS MS),以促进ETV 2-DPSCs的多重功能并进一步增强成骨分化。
最后,在动物水平上验证了ETV 2修饰的DPSCs与HA/CS MS在促进临界骨缺损再生方面的协同作用。
ETV 2-DPSC/MS通过局部缺氧信号稳态和能量代谢重编程对血管化骨再生的促进作用
研究意义
本研究提出了一种有效的应用策略,将ETV2-DPSCs与HA/CS MS结合,通过调节局部低氧信号的稳态和能量代谢重编程,同时实现快速的血管生成和骨再生。该方法在治疗骨缺损,特别是临界骨缺损的临床修复方面提供了广阔的前景。
吉满助力
本研究中所用的EGLN1(PHD2)过表达慢病毒 ,ETV2过表达质粒和pGL3-PHD2, pGL3-PHD2-MT1, pGL3-PHD2-MT2启动子报告基因质粒均由吉满生物提供。 了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288 原文引用 “An ETV2-encoding lentivirus based on doxycycline (Dox) induced and EGLN1(PHD2)-encoding lentiviruses(Genomeditech, China) was constructed. The putative binding regions of ETV2 in the human PHD2 promoter were amplified from genomic DNA and mutant fragments of the high-score-binding regions were generated using PCR. Target fragments were then inserted downstream of the firefly luciferase (FL) gene into the pGL3-basic luciferase reporter vector (Genomeditech) using seamless cloning.” 原文下载 声明:此推文仅代表作者个人观点,如有不科学之处,联系小编敬请指正!