文献解读

2025年3月,北京大学医学部冼勋德课题组在《Nature Communications》期刊发表了题为“SR-A3 suppresses AKT activation to protect against MAFLD by inhibiting XIAP-mediated PTEN degradation” 的文章。
研究发现,SR-A3在MAFLD患者和动物模型中的表达降低,其缺失会增强AKT激活,导致小鼠脂肪肝的加重;而SR-A3的过表达能够抑制高脂肪饮食诱导的脂肪肝。通过PTEN激动剂和降脂药物可以缓解MAFLD表现。
研究结果表明,SR-A3是调控肝脏能量代谢的重要因子,是MAFLD的潜在治疗靶点。
研究背景
代谢功能障碍相关脂肪性肝病 (MAFLD) 以肝脏中过量脂质积聚为特征,是最常见的慢性肝病,患病率呈逐年上升趋势,占总人口的近30%。它涵盖的疾病范围很广,从单纯的非酒精性脂肪肝(MAFL)到代谢功能障碍相关脂肪性肝炎(MASH),然后进展为纤维化、肝硬化等恶化表型,最终发展为肝细胞癌(HCC)。
尽管FDA最近批准了一种甲状腺激素受体激动剂用于治疗MASH,但由于MAFLD相关病因和病理的异质性和复杂性,开发新药已成为解决MAFLD问题的紧迫任务。
最近,越来越多的证据表明清道夫受体A类SR-A可能在代谢紊乱中发挥关键作用,SR-A3也可能在MAFLD发展中发挥作用。然而,SR-A3与MAFLD之间的关系尚未得到很好的确定,SR-A3如何控制MAFLD进展仍然难以捉摸。
项目研究
首先,研究者通过数据库分析及一系列实验证实了肝脏SR-A3表达水平与MAFLD发展之间存在负相关性。
为了进一步研究SR-A3如何参与MAFLD的发展,使用CRISPR/Cas9技术构建SR-A3缺失(SR-A3−/−)仓鼠并配合不同饮食喂养,实验结果表明SR-A3缺失会增加脂质积累和MASH的发展。
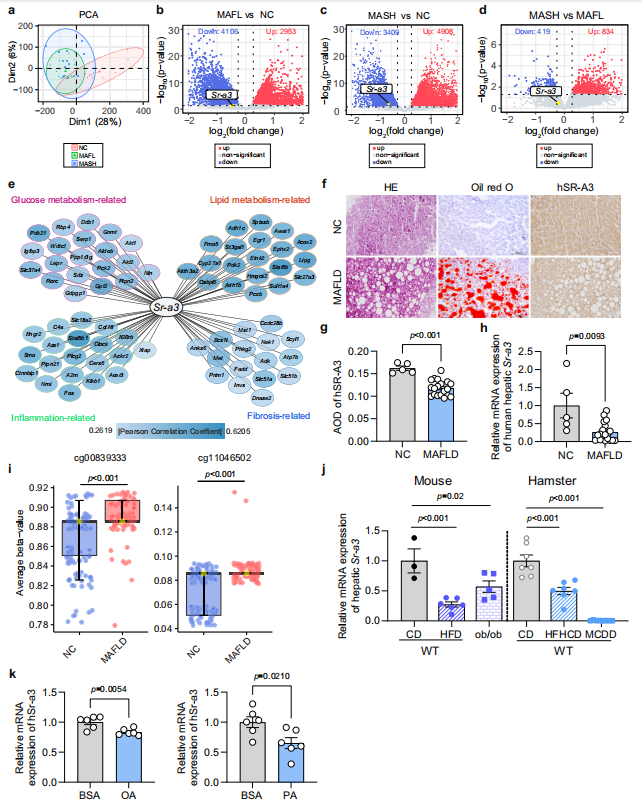
图1 患有MAFLD的患者、小鼠和仓鼠的肝脏 SR-A3 表达水平降低
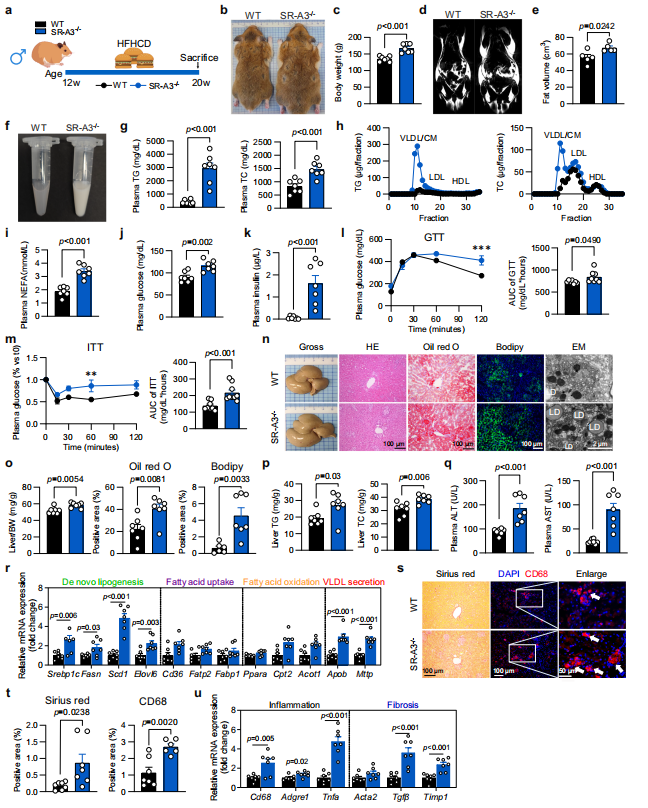
图2 SR-A3消融加重喂食HFHCD的雄性仓鼠的血脂异常、高血糖、胰岛素抵抗和MASH
为了进一步探索SR-A3减轻脂肪形成的分子机制,研究人员通过对不同饮食喂养的WT和SR-A3−/−仓鼠肝脏RNA测序分析,发现PI3K-AKT信号通路显著富集。
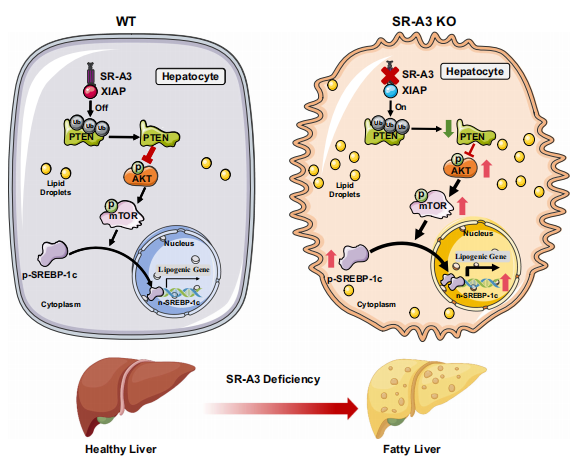
体外和体内实验表明SR-A3通过抑制XIAP介导的PTEN泛素化,阻断AKT介导的肝脏脂肪生成,从而防止肝脏脂肪变性。
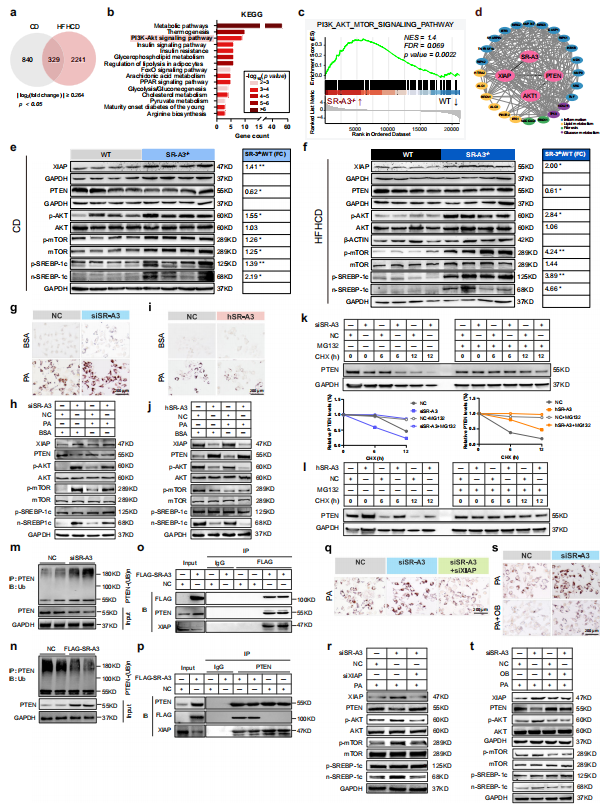
图3 SR-A3缺乏通过增强XIAP介导的PTEN泛素化和蛋白酶体降解来促进AKT过度活化
使用AAV8进行HFHCD诱导的WT仓鼠和遗传性肥胖ob/ob小鼠肝脏特异性hSR-A3过表达。结果显示,有助于维持葡萄糖和脂质稳态,减轻肝脏脂肪变性。
在机制上,hSR-A3通过抑制XIAP活性促进PTEN稳定性,从而减弱Srebp1c介导的脂肪生成,降低p-AKT、p-mTOR和SREBP-1c的下游效应物。
使用PTEN激动剂Oroxin B (OB)或降脂剂依折麦布两种药物治疗后,可改善SR-A3−/−仓鼠的代谢异常,表明了阻断SR-A3缺乏引起的AKT过度活化,OB和依折麦布可以在一定程度上逆转HFHCD引起的代谢异常。
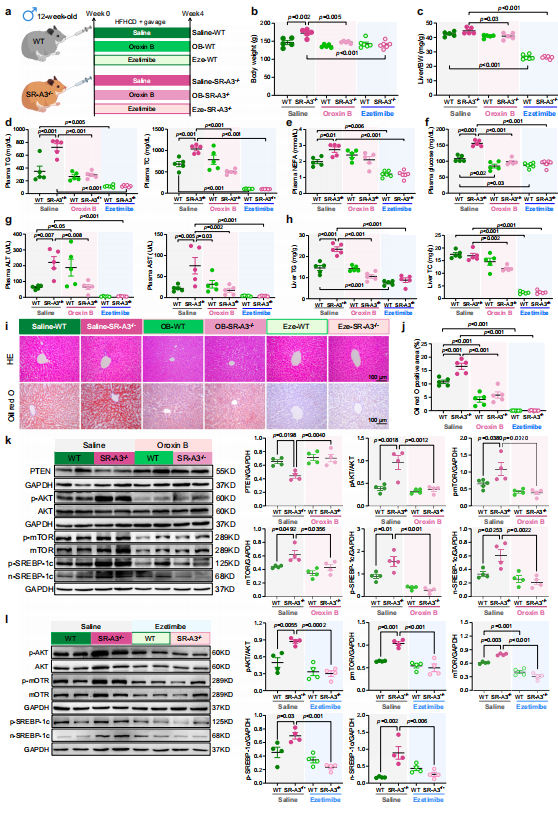
图4 AKT抑制可恢复脂质和葡萄糖稳态并改善仓鼠的HFHCD诱导的脂肪肝
研究结论
该研究首次证明了SR-A3在协调肝脏脂质和葡萄糖代谢以防止MAFLD方面发挥着重要作用,并为未来临床试验中在SR-A3缺乏的情况下治疗MAFLD的治疗方法提供了新的见解。
吉满生物
如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。
欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288














