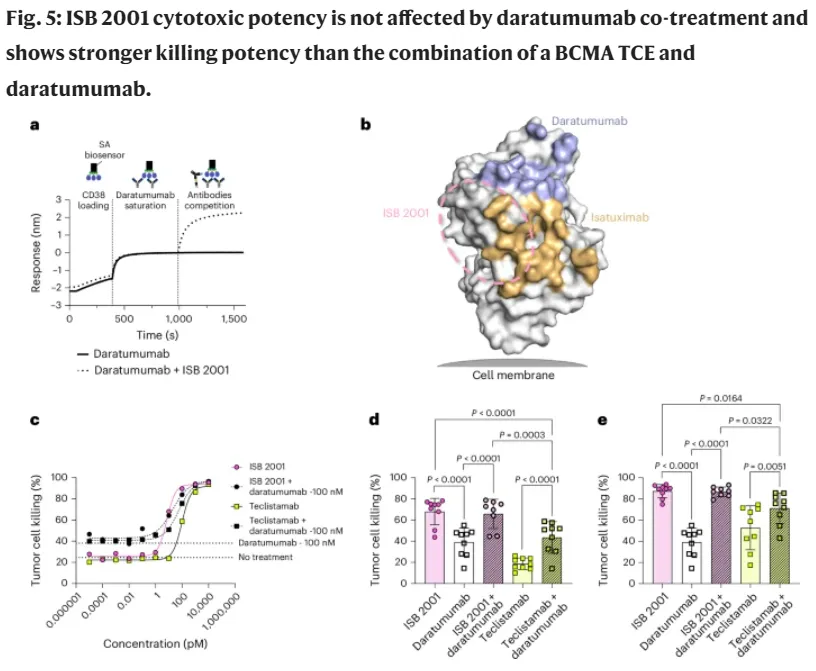
根据协议条款,艾伯维将获得在北美、欧洲、日本和大中华区开发、制造和商业化ISB 2001的独家权利。 根据监管部门的批准,IGI将获得7亿美元的预付款,并有资格获得高达12.25亿美元的开发、监管和商业里程碑付款,以及分层的两位数净销售额特许权使用费。 ISB 2001是同类首创的trispecific T-cell engager,靶向骨髓瘤细胞上的BCMA和CD38和T细胞上的CD3,目前处于复发/难治性多发性骨髓瘤1期。 ISB 2001使用IGI专有的BEAT®蛋白平台开发,用两种不同的针对骨髓瘤相关抗原的结合剂进行工程设计,即使在低靶表达水平下也能提高亲和力,同时旨在提高第一代双特异性抗体的安全性。 在2025年ASCO年会上,IGI以快速口头报告的形式提交了35名患者的数据,这些数据表明,在经过深度预处理的复发/难治性骨髓瘤患者群体中,当有效剂量≥50µg/kg时,35名患者持续的总体反应率(ORR)为79%,完全/严格的完全反应率(CR/sCR)为30%,具有良好的安全性。 美国FDA于2023年7月授予ISB 2001孤儿药称号,并于2025年5月授予治疗复发/难治性骨髓瘤患者的快速通道称号。