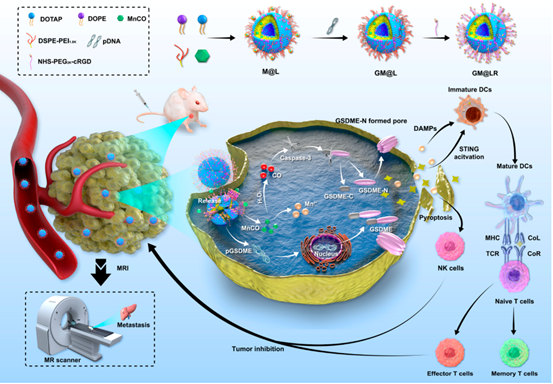
研究背景
乳腺癌是世界上最常见的恶性肿瘤,其中三阴性乳腺癌(TNBC)是一种难以治愈的类型,由于缺乏靶向药物,目前化疗仍是TNBC治疗的主要手段。
虽然免疫治疗策略在治疗各种癌症方面已显示出令人鼓舞的结果,然而,TNBC细胞通过降低其免疫原性来逃避宿主免疫系统,而免疫原性降低了肿瘤内细胞毒性T淋巴细胞(CTL)的浸润,化疗有时可通过释放损伤相关的分子模式分子(DAMPs)诱导免疫原性凋亡,增强肿瘤的免疫原性。然而,大多数化疗呈“无声死亡”过程,导致免疫反应微弱。
焦亡是细胞程序性死亡的一种促炎形式,它依赖于Gasdermin N端蛋白形成的质膜孔,最终释放大量的细胞内容物并引起有效的免疫应答。例如,化疗通常通过上调caspase-3的表达来诱导肿瘤细胞凋亡。如果肿瘤细胞表达GSDME, caspase-3可以将GSDME裂解至GSDME-C(GSDME C-末端)和GSDME- N (GSDME N -末端),使非炎性化疗诱导的细胞凋亡转化为炎性焦亡,激活抗肿瘤免疫。然而,GSDME在包括TNBC在内的许多癌症中被下调,即使在cleaved caspase-3过表达后也能阻止细胞焦亡。
文献来源
2023年5月,中山大学帅心涛课题组在《NANO LETTERS》期刊发表文章:Nanodrug Augmenting Antitumor Immunity for Enhanced TNBC Therapy via Pyroptosis and cGAS-STING Activation。
该团队构建了一种新型纳米脂质体(GM@LR),并利用其将表达GSDME的质粒和羰基锰(MnCO)共同递送到TNBC细胞中。在H2O2存在下,MnCO生成Mn2+和一氧化碳(CO)。CO活化的caspase-3切割表达的GSDME,使凋亡转化为焦亡。此外,Mn2+通过激活STING信号通路促进树突状细胞(DCs)的成熟。瘤内成熟树突状细胞比例增加,细胞毒性淋巴细胞大量浸润,引发强烈地免疫反应从而有效抑制肿瘤的生长。
MnCO/pGSDME纳米载体的制备(GM@L)示意图
纳米脂质体的特性
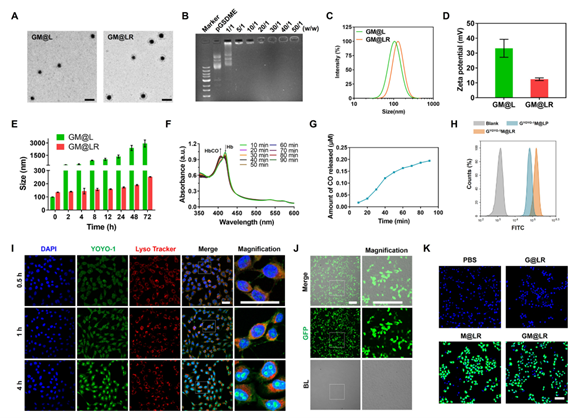
经测定表明GM@LR在H2O2存在下可以形成稳定的纳米复合物并生成CO。CO可触发凋亡通路,纳米药物内化后可诱导肿瘤细胞凋亡。
通过YOYO-1标记的pGSDME(绿色)来跟踪GM@LR通过4T1细胞的内在化,结果显示内化的GYOYO- 1M@LR纳米颗粒最初被转运到溶酶体,然后pGSDME被转运到细胞核(图1H和I)。由于MnCO产生的CO在细胞内的积累可以通过促进ROS的生成来诱导细胞凋亡。因此作者通过CLSM和流式细胞仪使用DCFH-DA探针测量细胞内ROS水平,GM@LR组处理后的细胞中ROS相关荧光最强。
图1 纳米药物的特性及其在细胞中的行为
项目研究
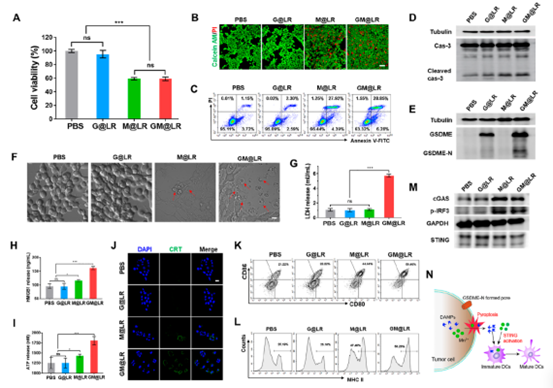
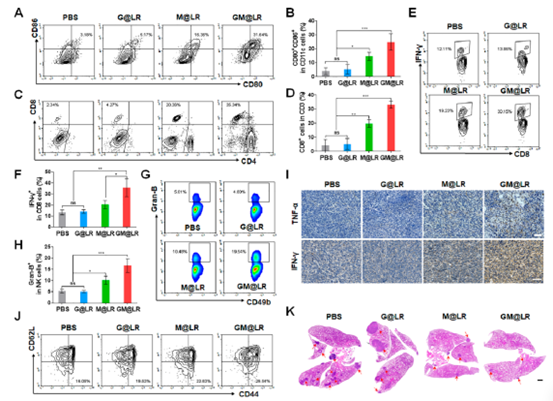
装载MnCO的纳米治疗(M@LR和GM@LR)导致4T1细胞活力降低(图2A)。GM@LR与M@LR相比也没有增加细胞死亡率,这表明添加pGSDME并不会导致额外的细胞毒性。在MnCO纳米药物处理的4T1细胞中检测到活化的caspase-3(图2D)。此外,经GM@LR处理的细胞表现出典型的细胞焦亡迹象,即肿胀和细胞膜破裂(红色箭头表示),GSDME- N蛋白表达显著增加。仅在GM@LR处理后的培养基中,乳酸脱氢酶(LDH)水平显著升高(图2G),进一步证实了细胞发生了焦亡。随后分析了GM@LR治疗后HMGB1和ATP水平均显著增加。
为了监测纳米药物对树突状细胞成熟的影响,将未成熟的骨髓来源树突状细胞(BMDCs)与处理后的4T1细胞的上清液一起培养。GM@LR组成熟DC (CD80+/CD86+)的百分比显著增加(图2K),MHC-II表达也显著上调(图3L),即表明DC成熟,抗原呈递能力增强。如图2M所示,装载MnCO纳米药物的BMDCs (M@LR和GM@LR)中,STING水平下调,cGAS和p-IRF3水平明显上调,表明cGAS-STING信号通路被激活。
以上得出,GM@LR诱导焦亡的4T1细胞释放大量内源性DAMPs(HMGB1和ATP)和上调CRT,随着Mn2+激活cGAS-STING信号通路,成熟DCs的比例增加(图2N)。
图2 纳米药物的体外细胞毒性、细胞焦亡和STING诱导
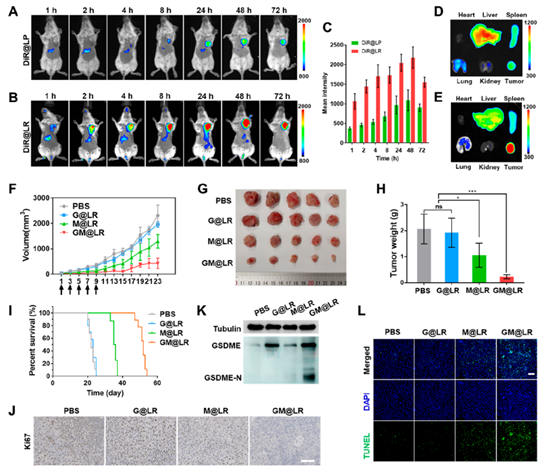
当原位肿瘤生长到约50mm3时,用不同的制剂(PBS、G@LR、M@LR和GM@LR)处理小鼠,并根据肿瘤体积和重量评价其抗肿瘤活性。如图3F−H所示,使用GM@LR治疗对肿瘤生长的抑制最大,这与最长的生存期相吻合(图3I)。此外,GM@LR对Ki67阳性细胞的抑制作用也最为明显(图3J)。进一步分析了GSDME-N在肿瘤组织中的表达。GSDME在装载pGSDME纳米药物的肿瘤中表达(G@LR和GM@LR),而GSDME- N仅在GM@LR组中表达(图3K)。因此,GM@LR诱导的肿瘤焦亡导致DAMPs暴露,可能导致更强的抗肿瘤作用。
图3 原位乳腺肿瘤小鼠的抗肿瘤作用
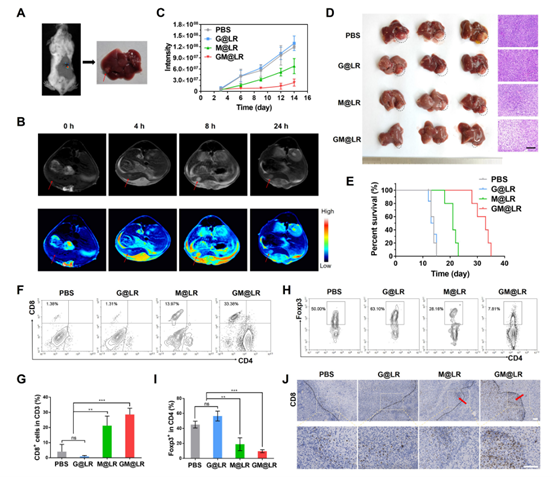
为了进一步证实GM@LR的抗肿瘤作用是一种有效的免疫反应的结果,随后测量了不同组的肿瘤免疫微环境。如图4所示GM@LR组中成熟的TIDC比例最高,对应的肿瘤内CD8+ T细胞比例也最高。其次,由于Mn2+促进TIDC的成熟,GM@LR诱导的焦亡在肿瘤部位引起了强烈的局部免疫反应,并转化为显著的肿瘤消退。通过建立了4T1肺转移模型来证实GM@LR还能激发抗肿瘤免疫记忆,有效地防止肿瘤转移。
图4 原位乳腺癌的免疫激活
肝转移是乳腺肿瘤常见的临床症状。作者建立了肝内转移瘤模型(图5A)。静脉注射GM@LR后,MRI T1加权像(T1WI)增强信号检测到界限清楚的高信号肝内转移瘤(图5B),提示GM@LR可以帮助MRI监测转移。术后3天对肝内转移瘤小鼠进行治疗(图5C),在GM@LR处理小鼠中检测到最低的荧光素酶信号,表明这种纳米药物有效地抑制了肝内转移性4T1肿瘤的生长。H&E染色也证实了GM@LR对肿瘤抑制最大,细胞凋亡显著(图5D)。同时,GM@LR治疗可显著延长了荷瘤小鼠的生存时间(图5E),CD80+CD86+成熟DC在转移瘤中的比例增加,肿瘤浸润性CD8+ T细胞增加(图5F,G),瘤内Treg减少(图5H,I)。总而言之,GM@ LR通过增强免疫反应对肝内转移瘤产生明显的抑制作用。
图5 转移性肝肿瘤的抗肿瘤作用
综上所述,该课题开发了一种PEG-cRGD修饰脂质体,包封MnCO和pGSDME,用于靶向治疗TNBC。
PEG-cRGD表面修饰不仅提高了其稳定性,而且增强了其靶向肿瘤的能力。在内源性高水平H2O2存在的4T1细胞中,被包裹的MnCO分解为Mn2+和CO,导致caspase-3激活。活化的caspase-3裂解全长GSDME诱导细胞凋亡,最终释放出大量的DAMPs。此外,Mn2+通过激活TIDC中的cGAS-STING通路增强了凋亡触发的抗肿瘤反应。这些协同作用显著抑制了原位和肝内转移性乳腺肿瘤的生长。
本研究提供了一种可能的策略,通过焦亡和cGAS-STING信号激活诱导抗肿瘤反应,同时结合免疫治疗和MRI诊断。
吉满助力
本实验中所用GSDME过表达质粒均由吉满生物构建。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
文献原文
https://doi.org/10.1021/acs.nanolett.3c01008
原文引用
“GSDME plasmid and GFP plasmid were established by
Genomeditech (Shanghai, China)Co.,Ltd (Shanghai, China).The mouse GSDME plasmid(gene ID: NM_018769.4) was established by Genomeditech (Shanghai) with the vector pcDNA3.1(+).”