研究背景
炎症性肠病(IBD),主要包括溃疡性结肠炎(UC)和克罗恩病(CD),已成为一种无法治愈的全球性疾病,其特征是反复发作的慢性胃肠道炎症。
在过去的十年中,用于诱导和维持 IBD 缓解的生物疗法和小分子疗法种类繁多。尽管取得了这些进步,但仍有约 30% 的患者对生物制剂无反应,而在最初有反应的患者中,50% 的患者会在一年内复发。此外,用于治疗 IBD 的大多数药物都具有免疫抑制作用,这可能导致患者对感染和癌症更加敏感。鉴于个体对这些药物的反应存在差异,有必要采用更多样化的治疗方法。
间充质干细胞(MSCs)在组织修复和免疫调节方面具有诸多优势,已成为治疗IBD的有潜力的治疗方法。间充质干细胞疗法的安全性和有效性已在 IBD 患者中得到证实,包括那些对传统临床或生物疗法无反应或被认为是药物难治性的患者。然而,静脉注射间充质干细胞已被证明不能有效地进入发炎的结肠组织,从而限制了间充质干细胞疗法的最佳利用率。
尽管全身输注间充质干细胞仍是治疗 IBD 的常用方法,但最近的研究表明,腹腔注射间充质干细胞在治疗结肠炎方面具有更好的疗效。然而,人们对这一现象的具体机制仍知之甚少,间充质干细胞在体内的精确分布及其腹腔注射后的生物学效应仍未得到充分了解。要阐明间充质干细胞在体内的精确分布与腹腔注射后产生的生物效应之间的关系,还需要进一步的研究。
文献来源
中国药科大学王广基院士/周芳/单云龙团队于2024年7月在Stem Cell Research & Therapy杂志上发表题为“Mesenteric lymph nodes: a critical site for the up-regulatory effect of hUC-MSCs on Treg cells by producing TGF-β1 in colitis treatment” 的研究性论文。
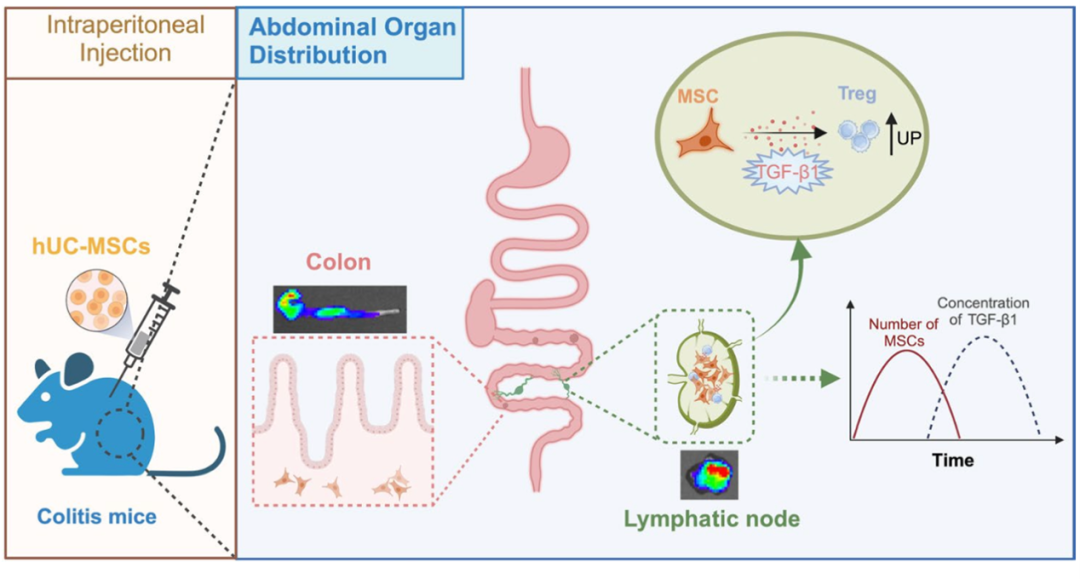
该研究以腹腔注射hUC-MSCs在结肠炎小鼠体内的肠系膜淋巴结分布特征为基础,探讨了hUC-MSCs调控IBD患者肠系膜淋巴结中免疫平衡的机制及其与肠系膜淋巴结分布特征之间的关系。
项目研究
首先,作者分析了人脐带间充质干细胞(hUC-MSCs)腹腔注射后肠系膜淋巴结(MLNs)中人脐带间充质干细胞(hUC-MSCs)的分布特征以及Treg和Th17细胞的数量。
随后,研究人员重点研究了Treg和Th17细胞生物学的关键细胞因子--转化生长因子β1(TGF-β1)在结肠炎小鼠组织中的水平,尤其是在肠系膜淋巴结中的水平。该研究还探讨了hUC-MSCs疗法对MLNs中Treg细胞数量的影响,以及TGFB1敲除hUC-MSCs对Treg细胞分化和IBD治疗的影响。
研究发现腹腔注射 hUC-MSCs治疗结肠炎的疗效显著,这与hUC-MSCs快速迁移到 肠系膜淋巴结(MLNs)并分泌 TGF-β1 密切相关。在结肠炎小鼠的MLNs中,hUC-MSCs的数量远远高于其他器官。
此外,研究还发现经 hUC-MSCs 治疗后,MLNs 中 Treg 分化的关键细胞因子 TGF-β1 的浓度也明显升高。腹腔注射 hUC-MSCs 显著增加了 MLNs 中Treg 细胞的数量,并减少了 Th17 细胞的数量。同时敲除 hUC-MSCs 中的 TGFB1 会导致 MLNs 中的 Treg 细胞明显减少,最终导致 hUC-MSCs 治疗结肠炎的失败。
研究结论
肠系膜淋巴结可能是hUC-MSCs对Treg/Th17细胞产生调节作用并对结肠炎产生治疗效果的关键部位。源自hUC-MSCs的TGF-β1能促进MLNs中局部Treg分化。这项研究将为开发基于MSCs的IBD患者治疗策略提供新思路。
吉满助力
本研究中所用的TGFB1 siRNA,RFP慢病毒均由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
原文引用
“hUC-MSCs were transfected in vitro with Lentivirus (Jiman Biotechnology, China) for stable expression of RFP fluorescent protein.
TGFB1 small interfering RNA (siRNA) were synthesized by Jiman Biotechnology (Shanghai, China).”
原文下载
DOI: 10.1038/s41392-024-02018-5
文章来源:课题组供稿