研究背景
2型糖尿病(T2D)是全球最常见的糖尿病类型,约占全球5.37亿糖尿病病例的90%。
T2D的一个主要特征是胰岛炎症,这种炎症反应在β细胞功能障碍中起着关键作用。胰岛内的炎症细胞、分子和细胞因子在引发和维持胰岛炎症过程中着重要作用,这些因素在T2D的发病机制中至关重要。尽管目前已有一些基于细胞因子的治疗策略取得了一定进展,但针对具体分子的靶向治疗仍处于空白阶段,因此亟需开发新的分子靶点和治疗方案。
免疫检查点分子在调节免疫反应、维持免疫稳态中发挥着重要作用。近年来的研究表明,免疫检查点分子不仅在免疫细胞中发挥作用,也在胰岛β细胞中表达,并参与调控胰岛素分泌等代谢过程。
B7-H4(也称为B7x或VTCN1)是一个典型的免疫检查点分子,它通过负向调节T细胞活性来调控免疫反应。此外,B7-H4的基因多态性与T2D的发生密切相关,这提示B7-H4可能在调节胰岛β细胞功能及T2D的发病过程中起到重要作用。
文献来源

近日,上海交通大学附属第九人民医院和上海科技大学iHuman研究所夏芳珍教授、陆颖理教授和刘艳教授合作在 Molecular Metabolism (影响因子 7.0)上发表了“免疫检查点分子B7-H4通过Stat5信号通路调节胆固醇代谢从而调节β细胞数量和胰岛素分泌(The immune checkpoint molecule B7-H4 regulates β-cell mass and insulin secretion by modulating cholesterol metabolism through Stat5 signalling)”的研究论文。
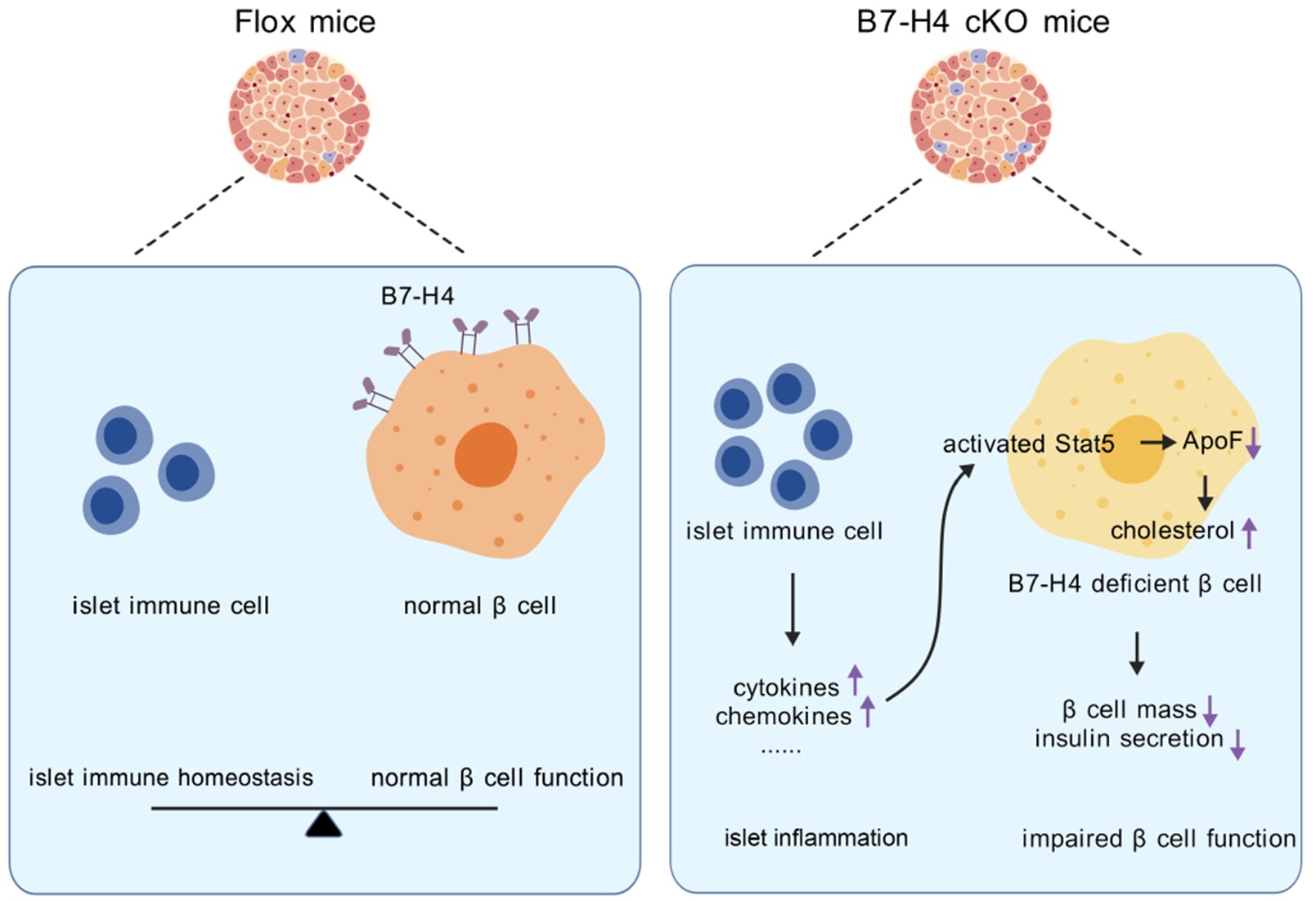
该研究发现,免疫检查点分子B7-H4是β细胞维持胰岛免疫稳态和正常功能的重要分子,调节β细胞的质量和胰岛素的加工和分泌。B7-H4通过下调Stat5信号,上调Apof的表达,进而增加β细胞胆固醇流出和葡萄糖诱导的胰岛素分泌。
项目研究
首先,作者通过生物信息学分析筛选出6个在2型糖尿病患者中表达显著改变的免疫检查点基因(其中包括B7-H4)。研究发现,B7-H4的表达在肥胖及db/db小鼠的胰岛中显著升高,并且与胰岛β细胞共表达。进一步利用小鼠Min6细胞系,作者发现IL-1β和高糖环境均能显著诱导B7-H4的表达水平升高。
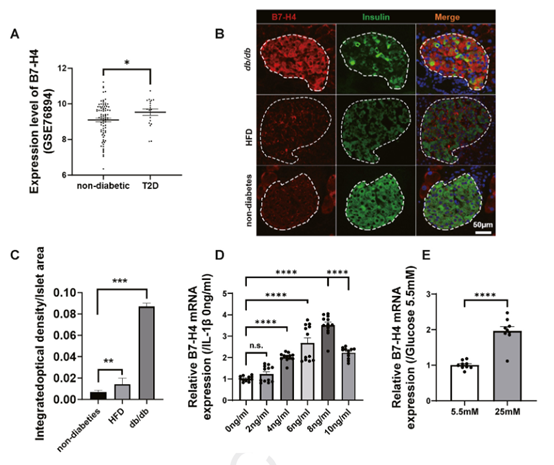
Fig.1 B7-H4在T2D β细胞中的表达上调
为了研究B7-H4在胰岛β细胞中的生理功能及其是否参与T2D的病理过程,作者构建了胰岛β细胞特异性敲除的B7-H4小鼠(B7-H4 cKO)。通过对普食和高脂饮食喂养的cKO小鼠与对照Flox小鼠进行比较,研究发现,B7-H4敲除小鼠的葡萄糖耐量显著下降,但胰岛素敏感性未见显著变化。
为了评估小鼠的胰岛素分泌功能,作者进行了体内和体外的葡萄糖刺激胰岛素分泌试验(GSIS)。结果表明,与Flox小鼠相比,cKO小鼠的胰岛素分泌能力显著受损。
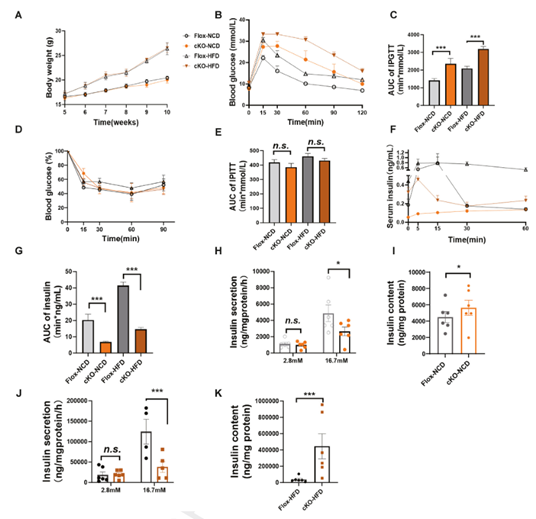
Fig.2 胰岛β细胞中敲除B7-H4
损害葡萄糖耐量和胰岛素分泌
β细胞的数量和功能决定了血液中的胰岛素水平。为了探讨胰岛素分泌受损是否与β细胞数量减少有关,作者通过免疫染色分析了小鼠胰岛的形态学变化。结果显示,cKO小鼠胰腺体部,特别是尾部的胰岛数量显著减少,同时,cKO小鼠胰腺尾部的β细胞面积也明显缩小,胰岛Ins-1与Ins-2 mRNA水平的下降进一步证明了cKO小鼠胰岛β细胞数量减少。进一步的分析发现,胰岛中细胞凋亡相关基因Caspase 3和Bax的表达水平上升,而抗凋亡基因Bcl2的表达水平下降,提示B7-H4可能通过调节细胞凋亡进程来影响β细胞数量。
此外,透射电子显微镜的观察结果显示,cKO小鼠的β细胞内囊泡体积显著缩小,且囊泡与质膜的距离明显增大。cKO小鼠中,参与胰岛素分泌囊泡转运的基因(Rab3a)以及启动胰岛素分泌的基因(Snap25、Vamp2)表达显著降低。上述结果表明,B7-H4不仅影响β细胞的数量,还影响其功能。
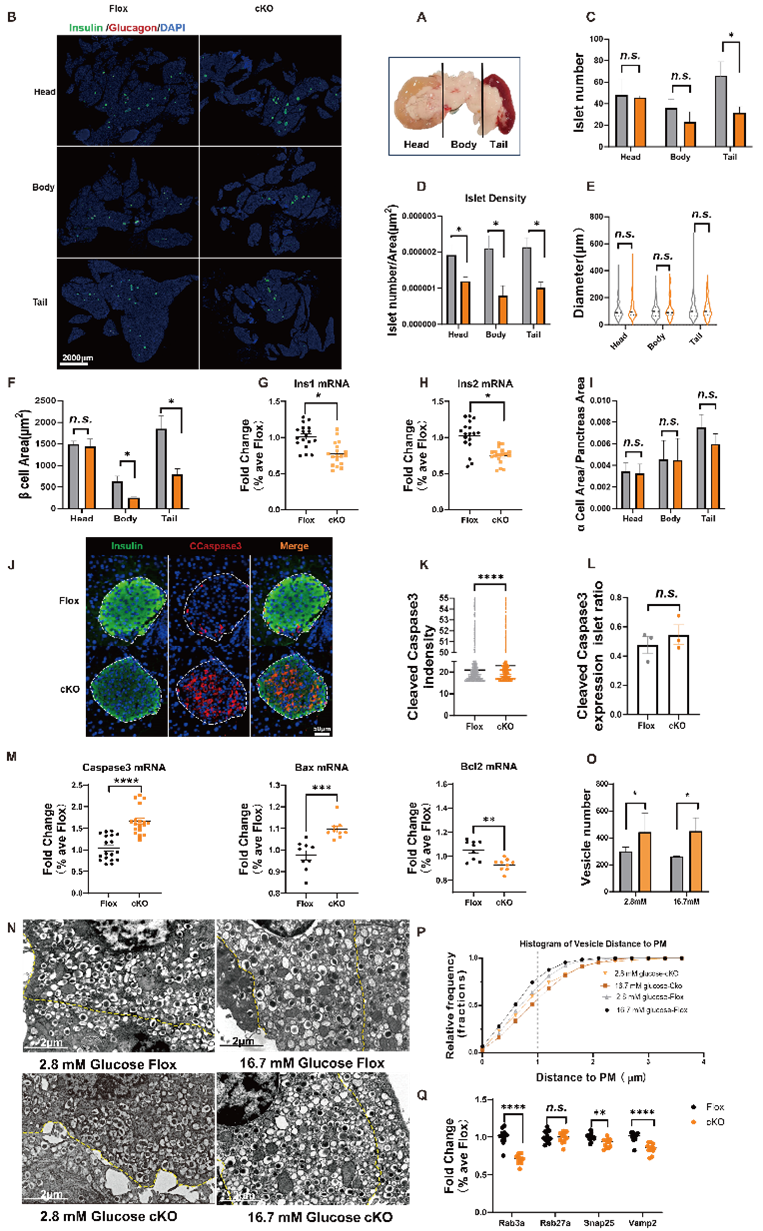
Fig3 B7-H4 c KO小鼠B细胞质量和
胰岛素的加工和分泌受损
在Flox小鼠中,作者通过使用AAV2/8-Ins2-B7H4病毒载体及对照病毒,特异性地在β细胞中过表达B7-H4。研究发现,过表达B7-H4显著改善了小鼠的葡萄糖耐受性和胰岛素分泌。这进一步表明,B7-H4参与了β细胞功能和数量的调节,并可能成为改善β细胞功能的潜在分子。
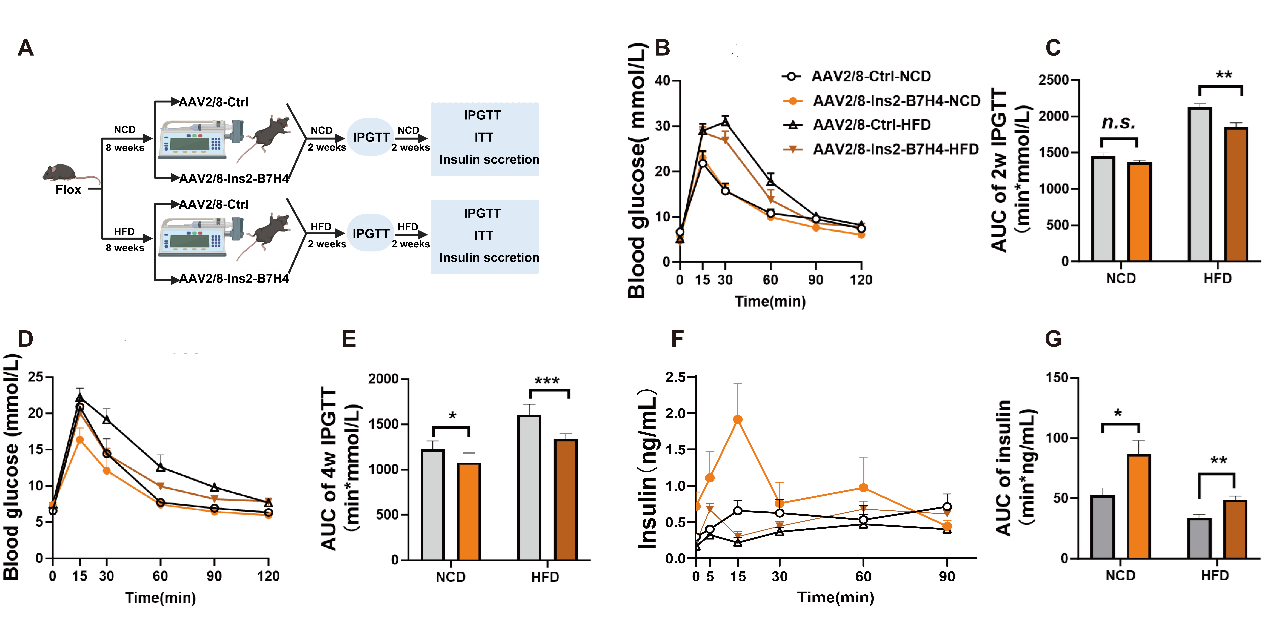
Fig.4 胰岛β细胞中过表达B7 - H4
可改善葡萄糖耐量和胰岛素分泌
为了进一步探讨B7-H4发挥保护作用的具体分子机制,作者对cKO小鼠、Flox小鼠以及注射了AAV2/8-Ins2-B7H4或AAV2/8-Ctrl病毒的小鼠胰岛进行了RNA测序分析。结果显示,cKO和Flox小鼠的差异表达基因(DEGs)主要富集在细胞因子-细胞因子受体相互作用、脂肪细胞因子信号通路、PPAR信号通路和钙信号通路等方面。
AAV2/8-Ins2-B7H4与AAV2/8-Ctrl小鼠的DEGs富集在细胞因子-细胞因子受体相互作用、脂肪细胞因子信号通路、糖尿病中的AGE-RAGE信号通路、钙信号通路以及胆固醇代谢通路中。GSEA分析结果显示,B7-H4 cKO小鼠的高尔基体到质膜转运和胰岛素分泌途径下调,而B7-H4过表达小鼠的胰腺分泌和胰岛素分泌途径正向调控上调。此外,B7-H4过表达还挽救了在高脂饮食(HFD)喂养的肥胖小鼠中β细胞成熟标志物、胰岛素合成与分泌相关基因以及胰岛内分泌细胞形成相关基因的表达异常。
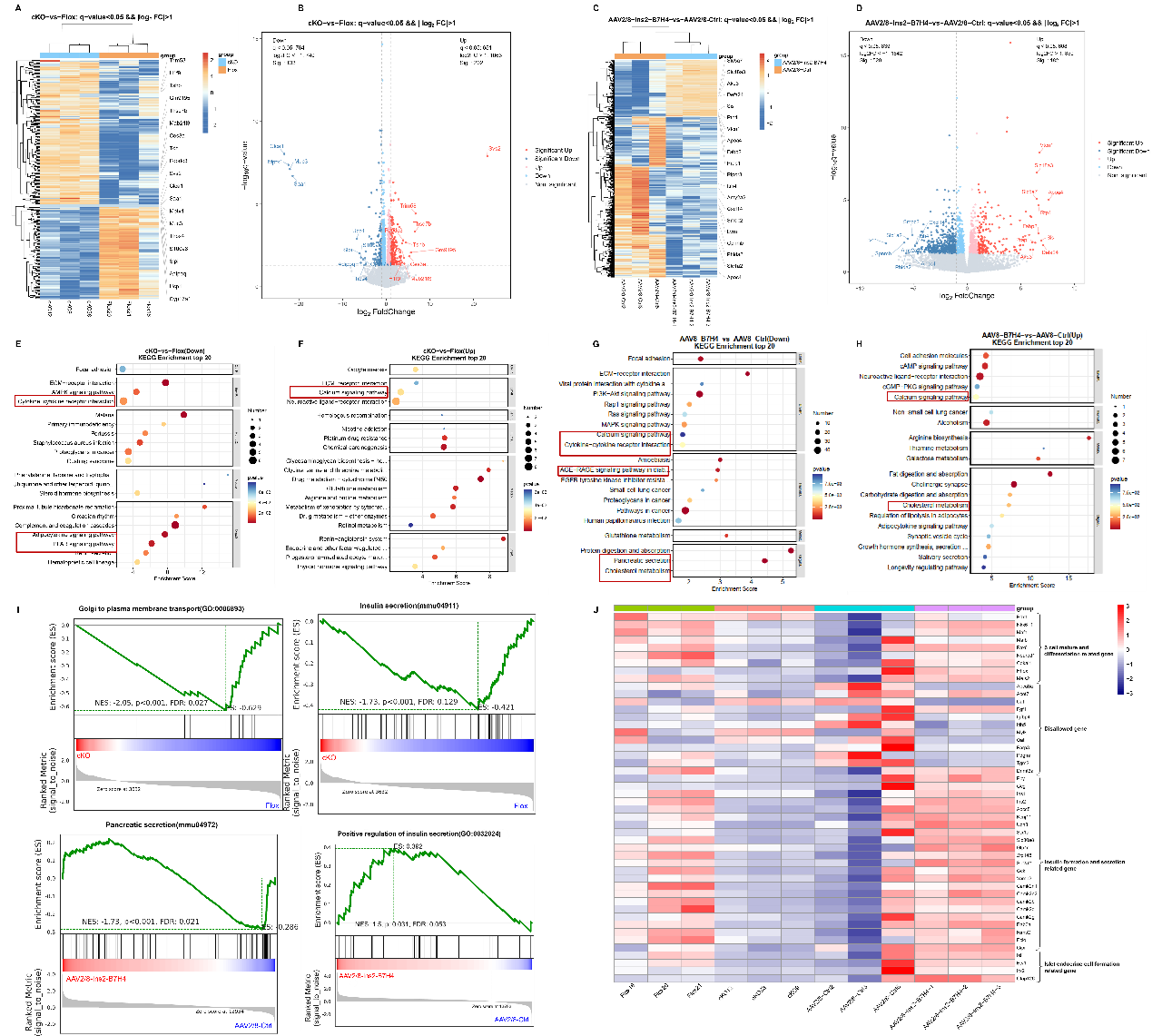
Fig.5 胰岛的RNA-seq表明B7-H4改变了胰岛β细胞功能和胰岛素分泌标志物的表达
作者对B7-H4 cKO小鼠和B7-H4过表达小鼠的胰岛差异基因进行了共同分析,发现有75个基因在cKO小鼠中表达显著改变,而在过表达小鼠中则表达被逆转。对这75个基因的功能分析表明,它们的功能主要富集在细胞粘附、胆固醇代谢和细胞因子受体活性等方面。KEGG富集分析进一步显示,JAK-STAT信号通路和钙信号通路也富集其中。
先前的研究表明,β细胞中的胆固醇含量会显著影响β细胞的囊泡和胰岛素含量。作者发现,cKO小鼠胰岛中的胆固醇浓度显著升高,而B7-H4过表达显著降低了高脂饮食(HFD)小鼠胰岛中的胆固醇浓度。
为了探讨这一现象的分子机制,作者利用GTEx数据库中的人类胰腺RNA-seq数据,根据B7-H4的表达水平将样本分为高表达组(表达水平前25%)和低表达组(表达水平后25%)。然后,将两组的差异基因与先前发现的75个基因进行共同分析,结果显示Apof是在人类和小鼠中共同受B7-H4调控的基因。
为了研究B7-H4是否通过Apof调节胰岛素分泌,作者在cKO和Flox小鼠的胰腺导管内注射了AAV2/8-Apof-3xFlag或AAV2/8-GFP对照病毒,促使胰腺中过表达Apof。实验结果显示,过表达Apof显著改善了cKO小鼠的糖耐量和胰岛素分泌,同时显著降低了cKO小鼠血清和胰岛内的胆固醇含量,减少了β细胞中滞留的囊泡数量。这些囊泡更小,且更靠近质膜,提示Apof改善了胰岛素分泌囊泡的分泌功能。
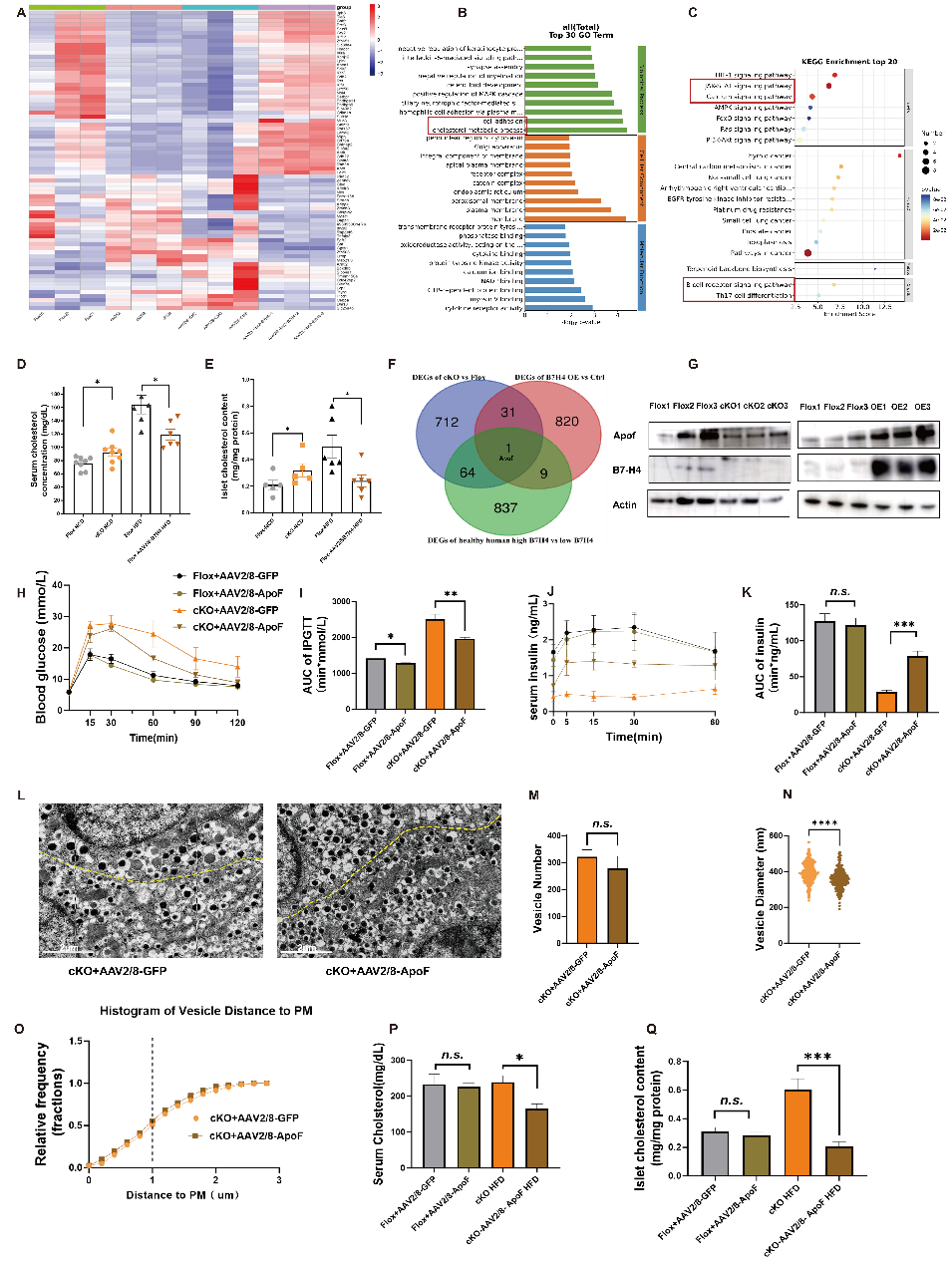
Fig.6 B7 - H4通过调节胰岛胆固醇代谢维持胰岛β细胞功能和胰岛素分泌
先前的研究表明,B7-H4可能参与胰岛免疫微环境的调控。为了进一步探讨这一机制,作者采用液相芯片法(Luminex)进行多因子检测,测量了小鼠血清中细胞因子的浓度。
结果显示,cKO小鼠血清中MDC/CCL22、eotaxin/CCL11、KC/CXCL1、TARC/CCL17、IFN-γ、MIP-1α/CCL3和MCP-3/CCL7的浓度较高,而CTACK/CCL27、IP-10/CXCL10、IL-2、I-309/CCL1、IL-1β和IL-4的浓度较低。组间差异分析显示,cKO小鼠血清中TARC/CCL17显著升高,而CTACK/CCL27显著降低。qPCR结果进一步表明,cKO小鼠胰岛中CCL17、CCL27、IL-4、IL-6、CCR4和CCR10的表达水平上升。以上数据表明,B7-H4可能通过调节这些细胞因子的表达,参与胰岛免疫微环境的调控。
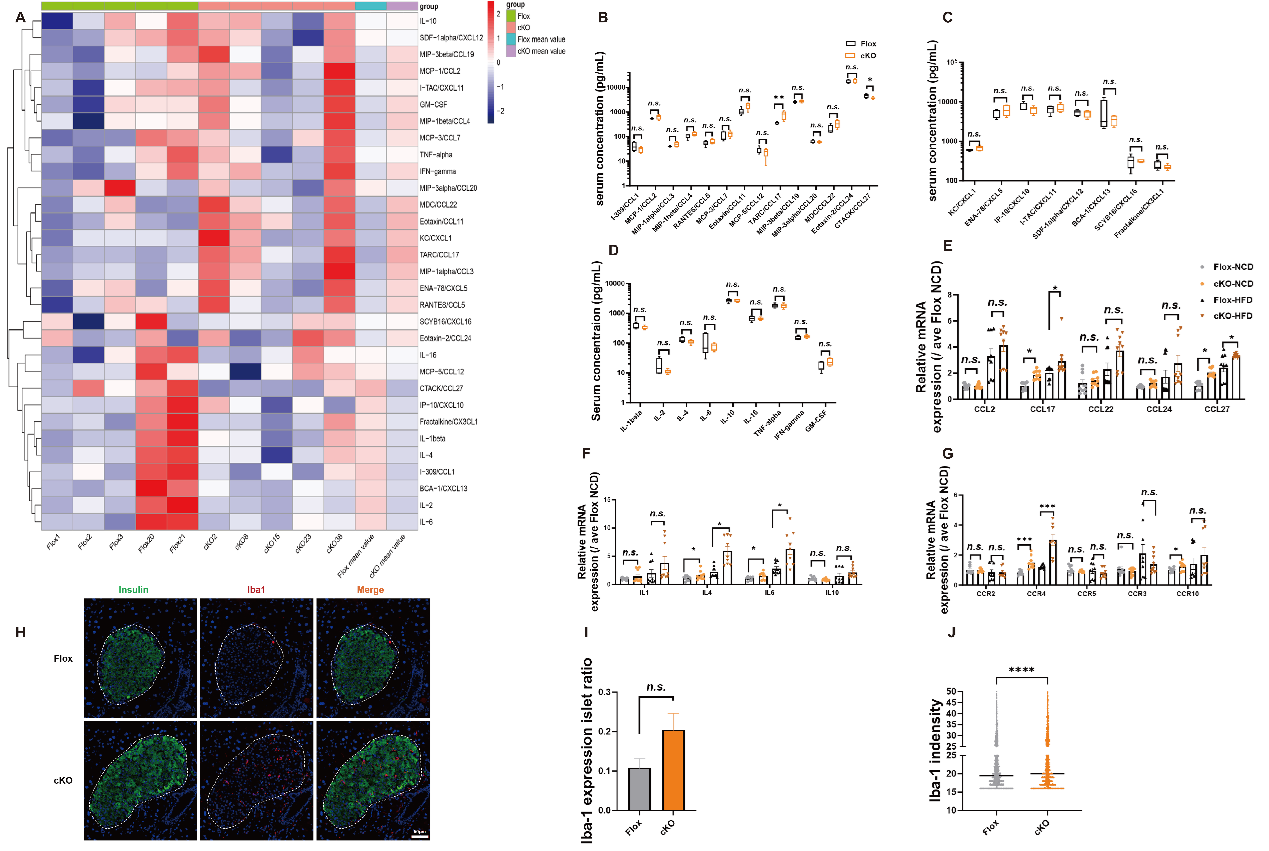
Fig.7 B7-H4调节胰岛细胞因子和趋化因子的表达,参与胰岛免疫微环境的调控
细胞因子可能通过激活JAK-STAT信号通路,参与B7-H4对胰岛β细胞功能和胰岛素分泌的调控。作者发现,cKO小鼠中Stat5的磷酸化水平显著升高,而B7-H4过表达小鼠中Stat5磷酸化水平则显著降低。
为了探讨B7-H4是否通过Stat5调节胰岛胆固醇代谢和胰岛素分泌,作者使用Stat5抑制剂pimozide或对照试剂(VC)处理cKO小鼠2周。结果显示,pimozide显著降低了cKO小鼠胰岛中Stat5的磷酸化水平,增加了Apof蛋白的表达水平,并显著改善了cKO小鼠的葡萄糖处理能力和胰岛素分泌功能。同时,pimozide也显著降低了cKO小鼠胰岛中的胆固醇水平。
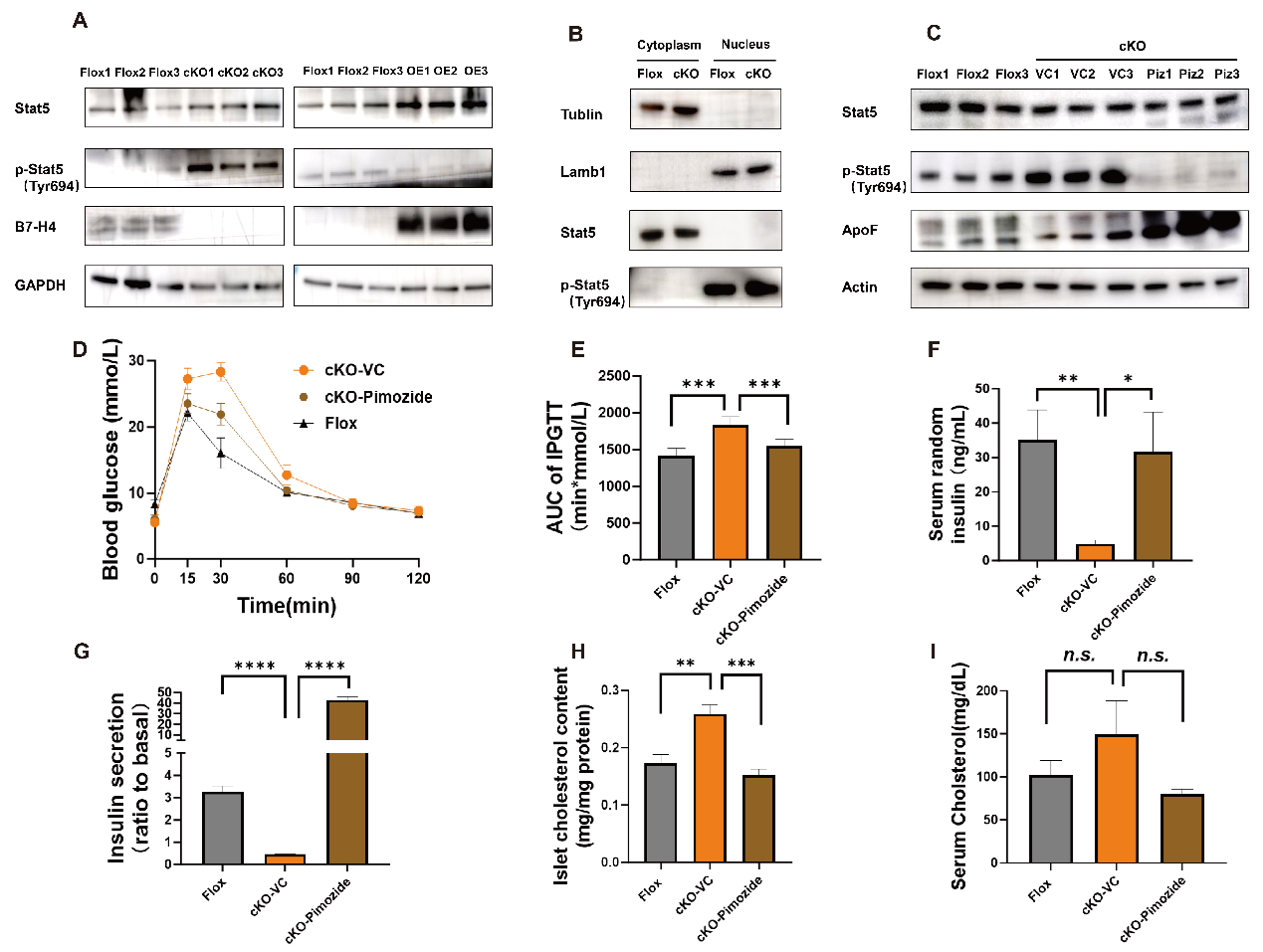
Fig.8 B7 - H4通过Stat5信号通路调节胰岛胆固醇代谢
研究结论
综上,该研究发现,免疫检查点分子B7 - H4通过Stat5信号通路调节胆固醇代谢,从而调节胰岛β细胞数量和胰岛素分泌,为T2D的治疗提供了潜在的分子靶点。
吉满生物
如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288














