12月17日,Teva Pharmaceuticals 和赛诺菲宣布,靶向TL1A抗体duvakitug在溃疡性结肠炎(UC)和克罗恩病(CD)患者中开展的2b期RELIEVE UCCD研究达到了主要终点。
据其新闻稿,duvakitug在UC和CD在高剂量治疗中的主要终点结果在目前所有TL1A单克隆抗体中疗效最佳。
Duvakitug (TEV'574/SAR447189)是一种针对TL1A的人类 IgG1-λ2 单克隆抗体,用于治疗中度至重度炎症性肠病 (IBD)。2023年10月4日,赛诺菲与梯瓦达成合作,共同开发后者TL1A抗体TEV'574,根据协议,Teva将获得约5亿美元预付款,以及约10亿美元的里程碑付款。
RELIEVE UCCD研究是一项为期14周的2b期随机、双盲、剂量范围研究,旨在确定duvakitug对中重度溃疡性结肠炎(UC)或克罗恩病(CD)成人患者的疗效、安全性、药代动力学和耐受性。
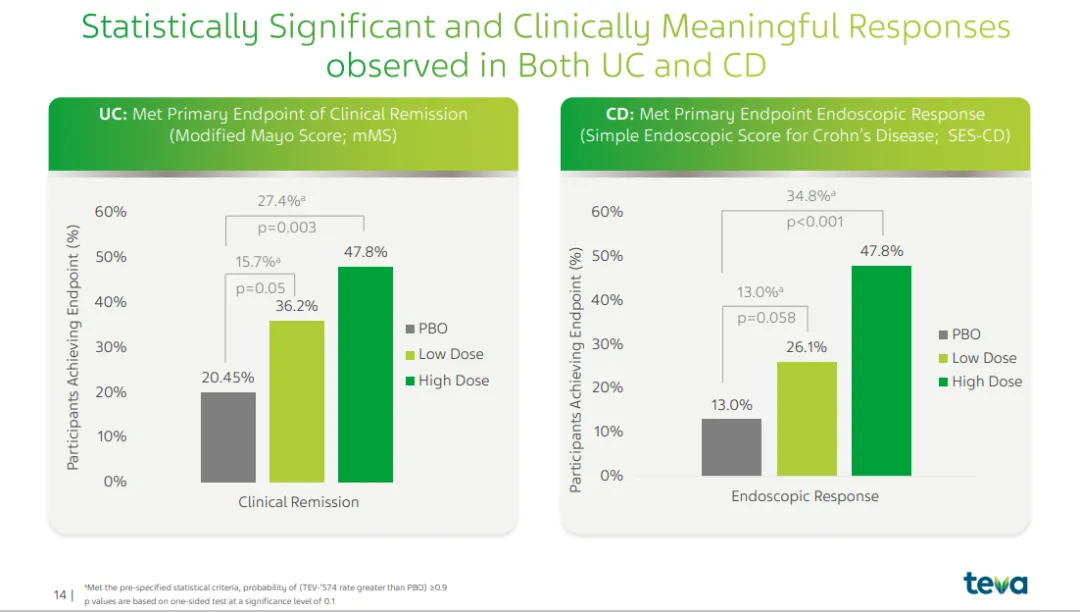
在RELIEVE UCCD 研究中,使用 duvakitug 治疗的溃疡性结肠炎患者中36.2%(低剂量)和 47.8%(高剂量)达到临床缓解,而使用安慰剂的患者这一比例为 20.45%,第 14 周时安慰剂调整后的比例分别为 15.7%(低剂量)和 27.4%(高剂量)(p 分别为 0.050 和 0.003)。
*在克罗恩病患者中,使用 duvakitug 治疗的患者中26.1%(低剂量)和 47.8%(高剂量)达到内窥镜反应,而使用安慰剂的患者这一比例为 13.0%,第 14 周时安慰剂调整后的比例分别为 13.0%(低剂量)和 34.8%(高剂量)(p 分别为 0.058 和 <0.001)。
*总体而言,各亚组的治疗效果一致。这是第一项也是唯一一项评估抗 TL1A 单克隆抗体对 CD 影响的随机、安慰剂对照研究。详细结果预计将于 2025 年的科学论坛上公布。
Duvakitug 在 UC 和 CD 中均具有良好的耐受性,未发现任何安全信号。duvakitug 和安慰剂在 UC 和 CD 中的治疗出现不良事件 (AE) 总体发生率相似(50% vs 50%)。UC 和 CD 中报告的所有 AE 均低于 5%。
赛诺菲和 Teva 计划启动 IBD 的 3 期临床开发。在UC和CD第三阶段启动时,TEVA将获得各2.5亿美元的开发里程碑付款。
Teva 全球研发主管兼首席医疗官 Eric Hughes 医学博士表示:“RELIEVE UCCD 研究的结果超出了我们的预期,duvakitug 有望帮助治疗 IBD 患者并显著改善其生活质量,这让我深受感动。这些积极的结果增强了 Teva 开发和加速创新药物获取的能力。我们很高兴能与我们的合作伙伴 Sanofi 合作开展下一阶段的开发,并感谢参与这项研究的研究人员和患者。”
赛诺菲执行副总裁、研发主管、医学博士、哲学博士 Houman Ashrafian 表示:“这些前所未有的结果表明,duvakitug 可能代表治疗溃疡性结肠炎和克罗恩病的下一个前沿。如果 3 期计划的效果持续,我们相信我们将为急需新选择的 IBD 患者提供差异化药物。duvakitug 计划和此次合作凸显了赛诺菲遵循科学寻找并快速推进突破性药物的战略。”
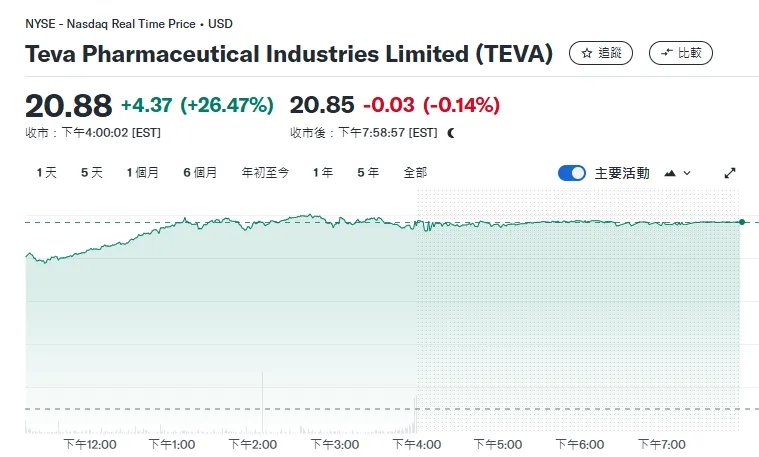
受此消息影响,Teva股价大涨26.47%!
吉满生物根据市场需求和研究现状,推出TL1A/DR3稳定过表达细胞系/报告基因检测细胞系/抗体/蛋白相关产品及服务,可用于抗体筛选、表征、一致性评价, 充分满足药物研发的需求,助力抗体药物临床申报。(咨询吉满客服联系同微信:18916119826)