文献解读

庆北国立大学医学院细胞与基质研究所团队在《Cancer Communications》上发表了题目为“IL2-mediated modulation of small extracellular vesicles secretion and PD-L1 expression: a novel perspective for neutralizing immune suppression within cancer cells”的研究论文。
作者通过在小鼠和人黑色素瘤细胞、小鼠肿瘤模型上的实验表明黑色素瘤细胞特异性IL2刺激可以强烈抑制肿瘤生长,降低肿瘤组织中Rab27a和 cPD-L1的表达,以及降低血浆中ePD-L1 的水平。IL2直接作用于癌细胞,通过IL2R-MEK/ERK信号传导减少sEV分泌和PD-L1表达。
研究背景
癌细胞分泌细胞外小囊泡(sEV),通过促进上皮-间充质转化和血管生成来调节各种细胞功能,如肿瘤生长和转移。癌细胞通过上调细胞程序性死亡配体1(cPD-L1)的表面表达来逃避免疫监视,cPD-L1与细胞毒性T细胞上的程序性细胞死亡1(PD-1)相互作用,抑制免疫反应。此外,癌细胞释放在其表面显示PD-L1的sEVs[4]。
癌症来源的外泌体PD-L1(ePD-L1)与癌细胞中的cPD-L1相似,可阻碍免疫细胞活化,诱导免疫抑制性肿瘤微环境。因此,调节癌细胞中sEV分泌或PD-L1表达可能是改变肿瘤微环境的关键策略。
项目研究
作者首先在b16f10细胞上对调节癌细胞sEV分泌的细胞因子进行了筛选鉴定,发现白细胞介素2(IL2)主要减少B16F10细胞中的sEV分泌,IL2是FDA批准的一种常用于黑色素瘤疗法的细胞因子,通常通过激活表达IL2受体复合物(IL2R)的免疫细胞来发挥抗癌作用。然而,IL2R也在某些类型的癌细胞中表达,包括黑色素瘤细胞。但是,IL2对表达IL2R的癌细胞的潜在影响尚未得到彻底研究。

图1 从38个白细胞介素家族细胞因子中鉴定调节黑色素瘤细胞小细胞外囊泡(sEV)分泌的细胞因子
用IL2处理表达IL2R的小鼠和人黑色素瘤细胞,随后分离sEV用于评估IL2对sEV分泌的影响。
与PBS对照组相比,IL2减少了分泌的sEV的数量并显著降低了RabGTP酶的表达,RabGTP酶可以调节黑色素瘤细胞中sEV的生物发生和分泌。这种效应与以前已知的IL2对免疫细胞中sEV调节的影响不同。
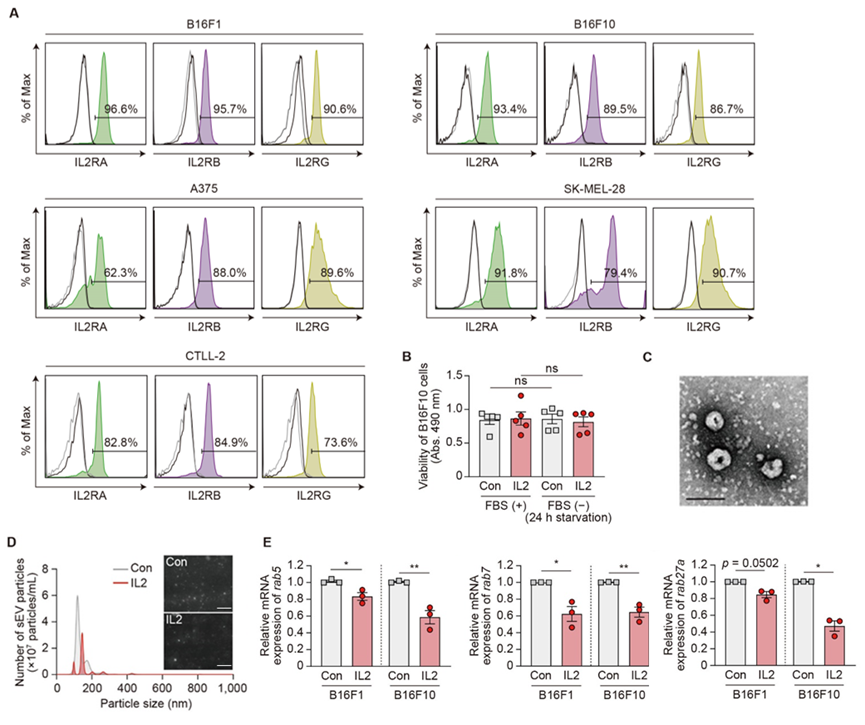
图2 白细胞介素-2(IL2)有效抑制小鼠黑色素瘤细胞的sEV分泌
除了研究IL2对癌细胞分泌sEVs的影响外,作者还研究了其对免疫检查点的影响,免疫检查点是免疫监视的关键调节因子。有趣的是,IL2治疗显著降低了黑色素瘤细胞cPD-L1水平,但不影响细胞增殖。
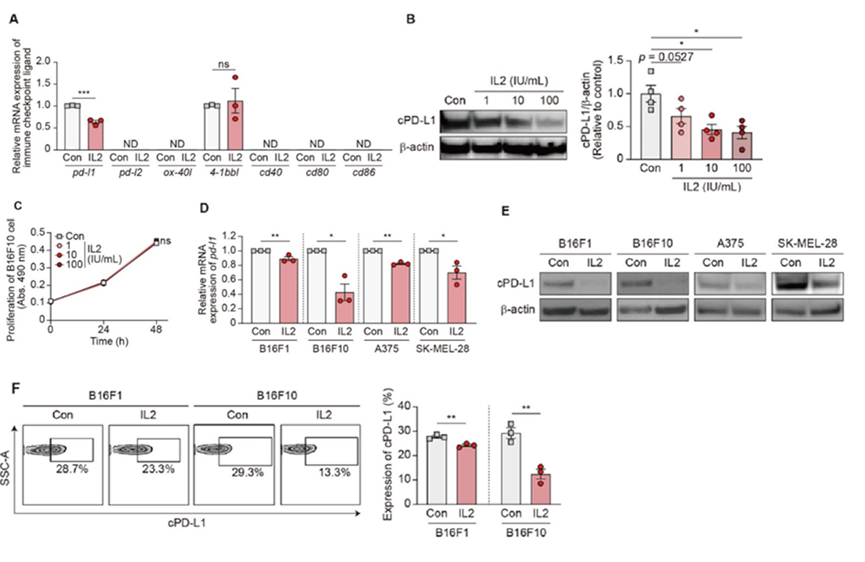
图3 IL2对黑色素瘤细胞PD-L1表达的抑制作用
接下来,作者评估了IL2对ePD-L1的调节是否影响CD8+T细胞活性。用PBS处理的B16F10细胞的sEV显著降低了CD8+T细胞中的颗粒酶B水平,而用IL2处理的B16F10细胞的sEV则没有这种现象。
sEVs对CD8+T细胞活化的抑制作用可以被抗PD-L1抗体消除。此外,作者观察到IL2介导的黑色素瘤细胞衍生的ePD-L1的表达降低增强了CD8+T细胞与癌细胞共培养的细胞毒性作用。这些数据表明,IL2引起的ePD-L1降低促进了CD8+T细胞的细胞毒性和癌细胞死亡。

图4 IL2通过降低外泌体PD-L1(ePD-L1)水平,增加CD8+T细胞对黑色素瘤细胞的细胞毒性作用
随后,分析了IL2在癌细胞中的作用是否取决于IL2R信号传导。IL2RB-IL2RG复合物的形成对于IL2信号转导至关重要。结果表明IL2RB和IL2RG的中和抗体恢复了IL2介导的Rab27a表达降低、sEV分泌减少以及cPD-L1和ePD-L1表达的降低。同样,IL2RB敲低消除了癌细胞中IL2介导的上述调节作用。
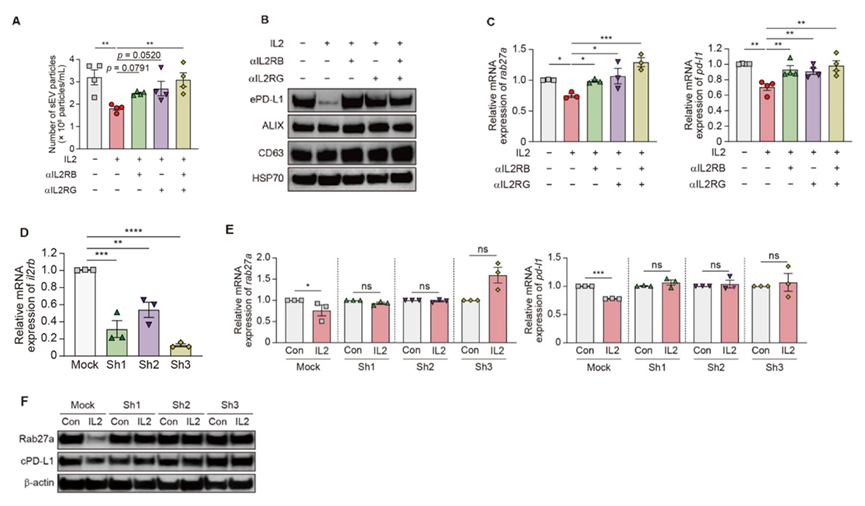
图5 IL2R依赖的黑色素瘤细胞中sEV分泌和PD-L1表达的调节
接下来,作者探索了IL2在黑色素瘤细胞中发挥作用的信号通路。IL2有效增加了黑色素瘤细胞中的ERK磷酸化,而STAT5和AKT磷酸化不受影响。
与使用STAT5抑制剂或PI3K抑制剂治疗不同,用IL2和MEK抑制剂共同处理黑色素瘤细胞消除了IL2对sEV分泌和PD-L1表达的抑制作用。表达dominant-negative ERK1的黑色素瘤细胞在IL2处理后磷酸化ERK、Rab27a和PD-L1水平没有改变。此外,MEK抑制剂减弱了黑色素瘤细胞对IL2诱导的T细胞介导的细胞毒性的敏感性增加。综上所述,这些结果表明IL2通过IL2R-MEK/ERK轴调节黑色素瘤细胞功能。
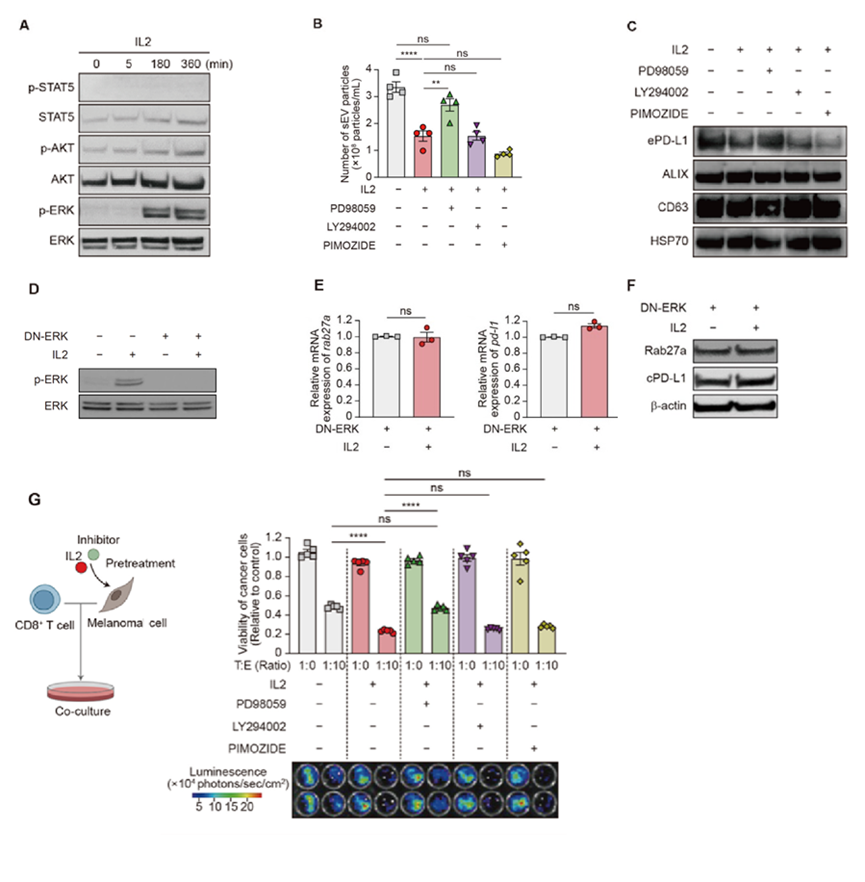
图6 黑色素瘤细胞中IL2对sEV分泌和PD-L1表达的MEK/erk依赖性调节
作者验证了在细胞水平观察到的IL2对癌细胞的影响是否可以扩展到小鼠肿瘤模型。于是开发了一种新方法,通过使用柔性接头将IL2锚定到癌细胞质膜上来分析IL2在体内的癌细胞特异性作用,从而实现无扩散的自我刺激。应用这种方法,可以观察到IL2处理和膜锚定IL2(IL2-T)小鼠的肿瘤生长显著减少,体重没有变化,但在对照小鼠中则没有。与对照小鼠相比,IL2-T小鼠与可溶性IL2处理的小鼠一样,肿瘤组织中Rab27a和cPD-L1的表达降低,血浆中ePD-L1的水平降低。这表明IL2的癌细胞特异性刺激可以限制癌细胞活性,例如sEVs分泌和PD-L1表达,类似于全身性IL2给药。
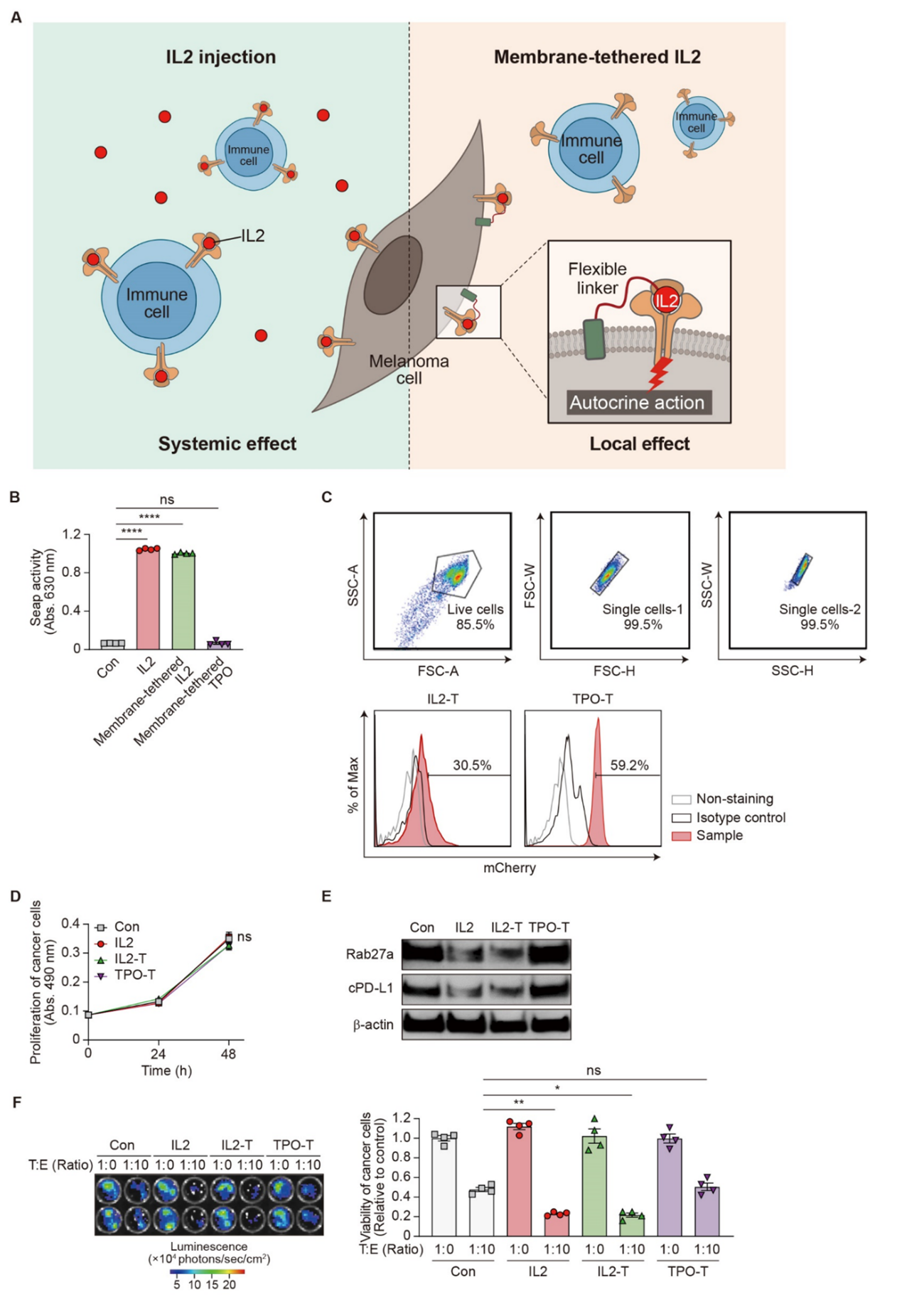
图7 附着在黑色素瘤细胞表面的IL2对癌细胞起特异性作用

图8 在同基因小鼠模型中,IL2作用于黑色素瘤细胞,降低Rab27a和PD-L1的水平
在之前的同基因小鼠肿瘤模型中,PD-L1可以在癌细胞和非癌细胞中表达,这导致血浆ePD-L1来源的不确定性。为了特异性分析癌细胞来源的ePD-L1,将人癌细胞移植到裸鼠体内,并测量人ePD-L1水平。正如预期的那样,IL2显着抑制了肿瘤组织中Rab27a和PD-L1的表达。与同基因小鼠结果一致,IL2治疗显着降低了人黑色素瘤细胞衍生的ePD-L1的血浆水平。这些数据表明IL2可以在体内降低癌细胞衍生的ePD-L1。
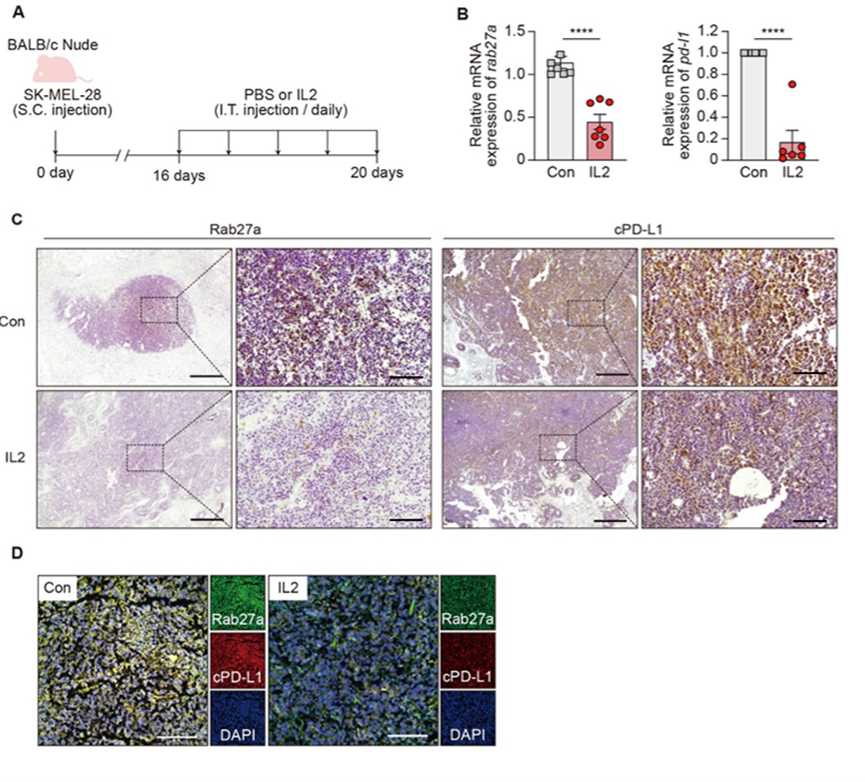
图9 IL2可降低小鼠异种移植瘤模型中Rab27a和PD-L1的水平
为了将这些发现扩展到其他癌症类型,作者研究了IL2对人类肺癌细胞的影响。IL2治疗下调了表达IL2R的肺癌细胞中的Rab27a和PD-L1水平,但在不表达IL2R的肺癌细胞中无下调。
此外,检查患者来源的肺癌细胞,发现IL2显着降低了来自7个供体的表达IL2R的肺癌样本中的Rab27a和cPD-L1水平。这些数据表明,IL2对癌细胞的影响在人类、小鼠和异质细胞类型中是保守的,为IL2机制提供了新的临床见解。

图10 IL2可降低表达IL2R的肺癌细胞中Rab27a和PD-L1的表达

图11 肺癌患者肿瘤细胞中IL2R的表达
研究结论
目前对IL2的研究主要集中在免疫细胞上,然而它在非免疫细胞(尤其是癌细胞)中的关键功能仍然知之甚少。
本研究表明,IL2直接作用于癌细胞,通过IL2R-MEK/ERK信号传导减少sEV分泌和PD-L1表达。在小鼠肿瘤模型中,黑色素瘤细胞特异性IL2刺激强烈抑制肿瘤生长,降低肿瘤组织中Rab27a和cPD-L1的表达,以及血浆中ePD-L1的水平。此外,IL2的疗效在患者来源的肺肿瘤细胞中得到证实,表明IL2在表达IL2R的肿瘤患者中具有潜在的临床意义。
这些发现提供了见解,通过提出新的免疫肿瘤学机制,可能拓宽IL2的临床适用性。进一步研究IL2对表达IL2R的癌症的直接影响,可能需要重新考虑将IL2作为各种癌症的重要治疗选择。
吉满生物
如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。
欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/cac2.12623














