实验干货
在上一篇 AAV靶向神经研究指南【血清型与启动子选型】中,我们系统阐述了如何在神经科学研究中选择合适的AAV血清型及启动子,这是实现特异性精准基因调控的基石。然而,能否将病毒载体高效、可控地递送至神经系统的目标区域,是决定实验成败的另一个关键环节。
选择合适的体内递送方式,不仅直接影响病毒的生物分布、转导效率和表达水平,也与实验的侵入性、可操作性以及结果的可重复性密切相关。
本文将系统比较三类主流的AAV注射策略,并结合适用场景与前沿案例,为研究者提供一份从方案设计到实操优化的综合指南。
神经系统注射方式定位与选择
基于病毒扩散范围和靶向精准度的差异,AAV在神经系统的递送方式可以分为全身性注射、局部注射和经脑脊液注射。这三种策略在侵入性、操作难度和应用重点上各有侧重。
全身性注射:广泛的非侵入性感染
这类方法通过血液循环使病毒到达神经系统,侵入性小,但所需病毒剂量较高,尤其适合需要全脑范围基因操作的研究,包括尾静脉注射、肌肉注射等。
尾静脉注射
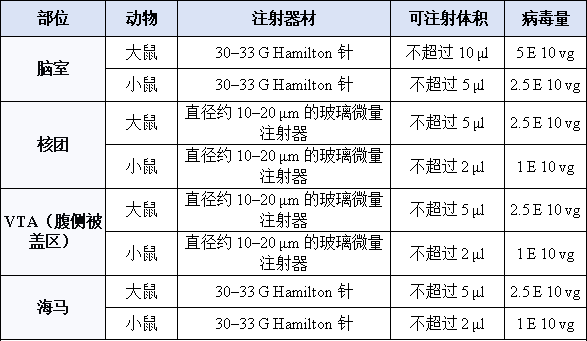
尾静脉注射在成年小鼠中常用,操作时需将小鼠固定,温水扩张尾静脉后进针注射。注射体积和用量推荐1-5E11vg/mL, 100μl。
*新生小鼠常用颞静脉注射,成年小鼠也可采用眶后静脉丛注射
肌肉注射
肌肉注射是一种独特的全身性给药方式,它依赖于某些AAV血清型(如AAV1, AAV6, AAV9)劫持轴突运输机制并沿着神经向心行进的能力。
病毒在肌肉纤维中表达后,可被运动神经元末梢摄取并逆向运输至脊髓中的胞体,从而实现对运动神经元的有效靶向。这一特性使其特别适合于运动神经元疾病的研究与治疗探索。目前AAV1、AAV6和AAV9在啮齿动物肌肉注射中已经实现了对运动神经元的有效靶向[1]。
全身性注射通常要求血清型具有穿越血脑屏障的能力,并且传递效率依赖于所使用的AAV血清型穿透血脑屏障的能力。
尽管AAV9已被证实具有一定穿透能力,但工程化血清型如AAV-PHP.eB、AAV-CAP-B10等能显著提高穿透效率,实现更高水平的中枢神经系统转导[2]。
局部注射:精准靶向
这类方法适用于需要精确干预的研究,能有效减少病毒用量和对外周组织的非特异性感染,可分为脑立体定位注射和局部原位注射两大类。
脑立体定位注射
操作时,动物被麻醉后固定在立体定位仪上,根据脑图谱确定目标脑区的三维坐标,然后钻孔进行病毒注射。关键在于缓慢注射(≤ 200 nl/min)并在注射后留针5-15min,以防止病毒液沿针道回流。此法非常适合帕金森病模型造模等需要特定核团干预的研究。
表1 脑立体定位注射推荐参数
局部原位注射
更适合局部组织的研究,包括髓内多位点注射[5]、双侧髓内注射[6]、脊髓软膜下注射[7]、聚焦超声鼻内递送[8]等。对于外周神经系统(如背根神经节、坐骨神经等),可直接采用局部原位注射。
*由于PNS缺乏像大脑那样精确的坐标图谱,这类注射方式更依赖研究人员的解剖学知识和技术经验。
经脑脊液注射:平衡覆盖与侵入性
这类方法旨在以相对微创的方式,实现病毒在脑脊液循环通路覆盖范围内的递送,从而感染脊髓和部分脑区组织,包括鞘内注射和脑室注射。
鞘内注射
将病毒注射到腰椎部位的蛛网膜下腔,病毒随脑脊液循环扩散,可感染脊髓和部分脑区。
这种方法相对脑实质内注射更微创,注射体积和用量推荐4.7E+10vg,10μl。研究显示,通过鞘内注射AAV9变体衣壳AAV-F,能在非人灵长类动物脊髓中介导广泛的转基因表达[9]。
脑室注射
将病毒直接注入侧脑室,病毒可感染脑室周围的组织。此法也需要立体定位仪辅助,但覆盖范围比直接脑实质注射更广[10]。
经脑脊液注射相比静脉注射,免疫反应和肝毒性风险较低;相比脑内局部注射,则能覆盖更广泛的脑区和脊髓节段。
客户案例解析
案例一:Microglial circDlg1 modulates neuroinflammation by blocking PDE4B ubiquitination-dependent degradation associated with Alzheimer's disease[10]
研究背景:阿尔茨海默病(AD)中的神经炎症是关键病理特征,而小胶质细胞作为中枢神经系统中的主要免疫细胞,在这一过程中扮演了双重角色。研究表明,环状RNA(circRNA)是一类结构稳定的非编码RNA,在大脑中含量丰富,但其在小胶质细胞驱动的AD神经炎症中的具体作用和机制知之甚少。
研究结论:该研究首次揭示circDlg1是AD中小胶质细胞功能调控的一个关键上游分子,并阐明了其通过“冻结”其下游的PDE4B蛋白降解来加剧神经炎症的新机制,深化了对AD病理复杂性的认识,为开发旨在调节神经炎症、而非单纯靶向Aβ或Tau蛋白的疾病修饰疗法提供了新思路和实验依据。
实验细节
动物:6个月大的雄性WT和APP/PS1小鼠
靶向:脑小胶质细胞
注射方式:脑立体定位注射,侧脑室
注射体积和病毒用量:每只小鼠1×1011个病毒基因组,在10分钟内显微注射到侧脑室中
观察时间:60天,检查空间学习和记忆能力
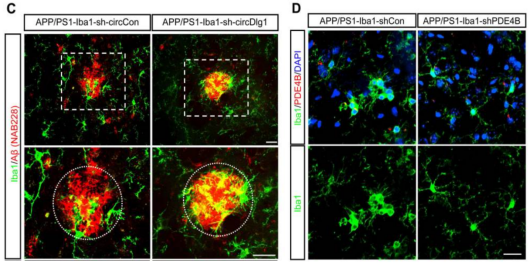
注射相应AAV9后APP/PS1小鼠的皮质中免疫染色图像
C:小胶质细胞和Aβ斑块共染色
D:小胶质细胞和PDE4B共染色
吉满助力:AAV9(特异性启动子为Iba1);质粒(CircDlg1、Flag-PDE4B1、Flag-PDE4B2、Flag-PDE4B3、Flag-PDE4B1)
案例二:Lactate promotes microglial scar formation and facilitates locomotor function recovery by enhancing histone H4 lysine 12 lactylation after spinal cord injury[11]
研究背景:脊髓损伤后,局部微环境的细胞代谢从高效的有氧呼吸转向低效的无氧糖酵解,导致大量乳酸堆积。与此同时,中枢神经系统的小胶质细胞会被迅速激活并聚集在损伤区域边缘,形成胶质瘢痕。传统观点认为,胶质瘢痕是阻碍轴突再生的物理和化学屏障。然而,近年研究也提示,在急性期,这种瘢痕的形成具有一定的保护作用。那么,损伤区域高浓度的乳酸,是否在调控小胶质细胞功能从“有害”向“有益”表型转变中扮演着重要的“信号分子”角色,就成为一个非常关键的科学问题。
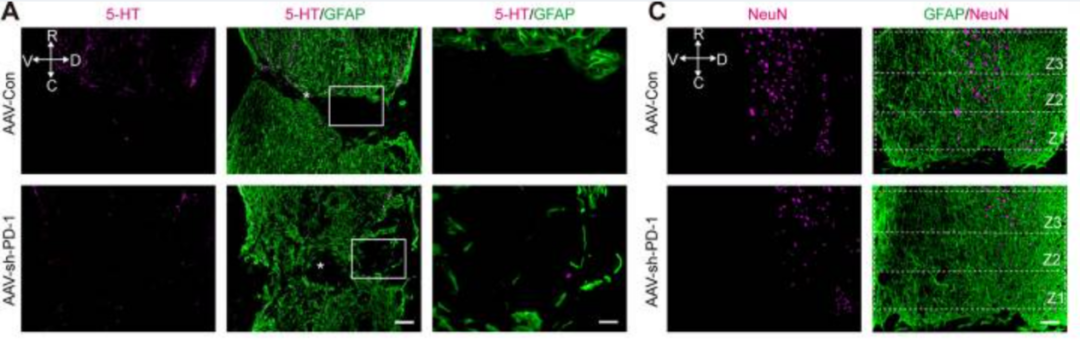
研究结论:该研究揭示了脊髓损伤后微环境中的乳酸通过一种新型表观遗传修饰——组蛋白乳酸化,来诱导小胶质细胞形成保护性瘢痕,从而发挥神经保护功能。研究进一步阐明乳酸/H4K12la/PD-1信号通路在小胶质细胞介导的组织修复中的作用和机制,为脊髓损伤治疗提供了新的靶点。
实验细节
实验动物:8周龄C57BL/6 J小鼠(18-22g)
靶向:脊髓小胶质细胞
注射方式:脊髓内注射
注射体积和病毒用量:将病毒载体(5×109 vg;1μl)以200nl/min的速度注射到脊髓中。
AAV-Con和AAV-sh-PD-1在小鼠体内第28天的脊髓损伤部位免疫荧光图像
吉满助力:AAV9(特异性启动子为CX3CR1)
案例三:Suppressing DUSP16 overexpression induced by ELK1 promotes neural progenitor cell differentiation in mouse models of Alzheimer's disease[12]
研究背景:阿尔茨海默病(AD)是一种严重的神经退行性疾病,表现为认知功能丧失和记忆障碍。证据表明,神经再生恢复是预防AD发病和拮抗其进展的有效策略,包括移植再生和内源性再生,其中内源性再生通过促进海马神经前体细胞(NPC)的增殖与分化,为AD治疗提供了新方向。然而,AD条件下参与内源性再生的分子机制仍有待阐明。
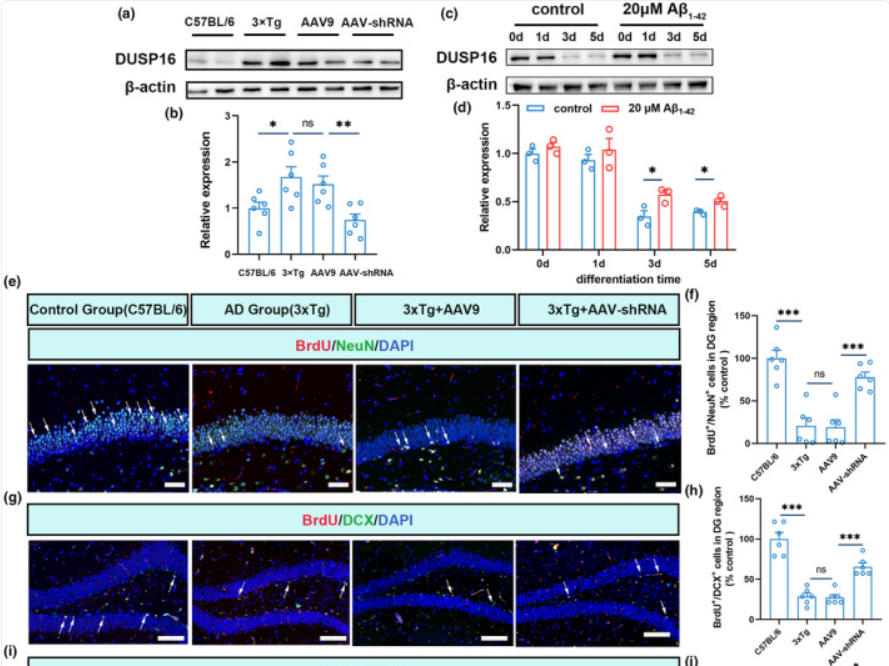
研究结论:该研究通过尾静脉注射能高效穿透血脑屏障的AAV-PHP.eB血清型病毒,系统性敲低DUSP16的表达,在AD模型中确认ELK1-DUSP16-MAPK这条信号轴的存在,阐明了ELK1通过上调DUSP16表达抑制NPCs分化的机制。
实验细节
动物:AD模型动物,4或5个月大的雄性3xTg和SAMP8小鼠
靶向:海马
注射方式:尾静脉注射
病毒用量:1×1013病毒基因组/mL,25μl
观察时间:60天,检查空间学习和记忆能力。
沉默DUSP16拯救了AD小鼠神经前体细胞受损的神经分化
吉满助力:pGL3报告基因质粒;AAV9、AAV9-shRNA、AAV-PHP.eB(特异性启动子为DUSP16)
吉满服务
成功的AAV实验依赖于病毒工具、递送策略与专业支持的紧密配合。
吉满生物提供全面且灵活的AAV服务,精准匹配客户的实验需求,助力您的神经科学研究。
如果您正在设计神经科学相关实验,不确定如何选择最佳的AAV策略,欢迎联系我们!
吉满优势
丰富的血清型选择:提供AAV1, 2, 5, 6, 7, 8, 9, DJ, DJ/8, rh10, PHP.S, PHP.eB, Retro, CAP-B10, MG1.2等多种血清型,满足从大脑全局到脊髓、外周神经等不同组织的靶向需求
灵活的启动子库:拥有种类丰富的广谱启动子和神经系统特异性启动子,同时提供Cre-Loxp、shRNA、Cas9-sgRNA、过表达等丰富的现货与定制服务
可靠的质量与交付:采用AAV Helper-Free System和三质粒共转染技术,确保高安全性;病毒滴度可达1×10¹³ vg/mL;从质粒构建到病毒发货约需5周
完善的客户服务体系:服务经验超过十四年,技术支持、项目跟进、售后服务获得众多客户好评!已助力客户在Cell, Science, Nature等顶级期刊上发表近万篇SCI论文,拥有丰富的实战案例
吉满生物14周年庆
恰逢吉满生物14周年庆典,我们诚意推出明星产品特惠活动——质粒构建、病毒包装、细胞株构建三大核心产品全线优惠,统统都降至冰点价。
如果您对我们的产品和技术服务有任何需求,欢迎随时联系,我们将竭诚为您服务。

参考资料:
[1] Hudry E and Vandenberghe L H. Therapeutic AAV Gene Transfer to the Nervous System: A Clinical Reality. Neuron. 2019, 101(05): 839-862. DOI: 10.1016/j.neuron.2019.02.017.
[2] Chan K Y, Jang M J, Yoo B B, et al. Engineered AAVs for Efficient Noninvasive Gene Delivery to the Central and Peripheral Nervous Systems. Nature Neuroscience, 2017, 20(08): 1172-1179. DOI: 10.1038/nn.4593.
[3] Zhang X, He T, Chai Z, et al. Blood-Brain Barrier Shuttle Peptides Enhance AAV Transduction in the Brain after Systemic Administration. Biomaterials. 2018, 176: 71-83. DOI: 10.1016/j.biomaterials.2018.05.041.
[4] Hordeaux J, Yuan Y, Clark PM, et al. The GPI-Linked Protein LY6A Drives AAV-PHP.B Transport across the Blood-Brain Barrier. Molecular Therapy, 2019;27(05):912-921. doi:10.1016/j.ymthe.2019.02.013.
[5] Griffin J M, Fackelmeier B, Fong D M, et al. Astrocyte-Selective AAV Gene Therapy through the Endogenous GFAP Promoter Results in Robust Transduction in the Rat Spinal Cord following Injury. Gene Therapy. 2019, 26(05):198-210. DOI: 10.1038/s41434-019-0075-6.
[6] Liu S, Zhang W, Yang L, et al. Overexpression of Bone Morphogenetic Protein 7 Reduces Oligodendrocytes Loss and Promotes Functional Recovery after Spinal Cord Injury. Journal of Cellular and Molecular Medicine. 2021, 25(18):8764-8774. DOI: 10.1111/jcmm.16832.
[7] Bravo-Hernandez M, Tadokoro T, Navarro M R, et al. Spinal Subpial Delivery of AAV9 Enables Widespread Gene Silencing and Blocks Motoneuron Degeneration in ALS. Nature Medicine. 2020, 26(01): 118-130. DOI: 10.1038/s41591-019-0674-1.
[8] Ye D, Yuan J, Yang Y, et al. Incisionless Targeted Adeno-Associated Viral Vector Delivery to the Brain by Focused Ultrasound-Mediated Intranasal Administration. EBioMedicine. 2022, 84: 104277. DOIi: 10.1016/j.ebiom.2022.104277.
[9] Beharry A, Gong Y, Kim J C, et al. The AAV9 Variant Capsid AAV-F Mediates Widespread Transgene Expression in Nonhuman Primate Spinal Cord After Intrathecal Administration. Human Gene Therapy, 2022, 33(01-02): 61-75. DOI: 10.1089/hum.2021.069.
[10] Shi J, Song C, Zhang P, et al. Microglial circDlg1 Modulates Neuroinflammation by Blocking PDE4B Ubiquitination-Dependent Degradation Associated with Alzheimer's Disease. Theranostics, 2025, 15(08): 3401-3423. DOI: 10.7150/thno.104709.
[11] Hu X, Huang J, Li Z, et al. Lactate Promotes Microglial Scar Formation and Facilitates Locomotor Function Recovery by Enhancing Histone H4 Lysine 12 Lactylation after Spinal Cord Injury. Journal of Neuroinflammation, 2024, 21(01): 193. DOI: 10.1186/s12974-024-03186-5.
[12] Zhao H, Mu Y, Liang A, et al. Suppressing DUSP16 Overexpression Induced by ELK1 Promotes Neural Progenitor Cell Differentiation in Mouse Models of Alzheimer's Disease. Aging Cell, 2025, 24(02): e14372. DOI: 10.1111/acel.14372.