靶点专栏
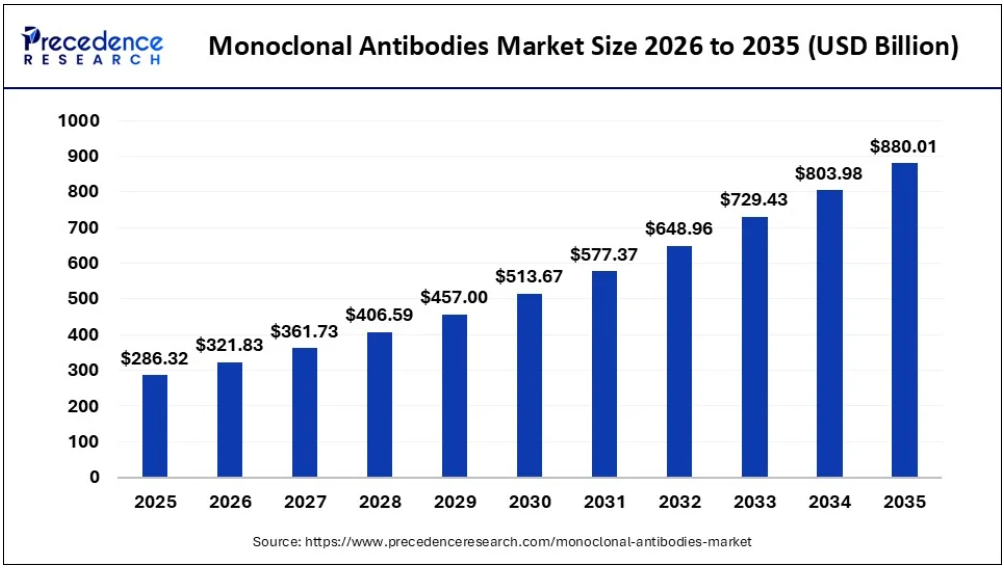
据Precedence Research数据,2025年全球单克隆抗体市场规模预计为2863.2亿美元,并将从2026年的3218.3亿美元增长到2035年的约8800.1亿美元,2026–2034 年复合年增长率为 11.88%[1]。
随着抗体工程和蛋白设计技术的发展,抗体已从天然免疫分子转变为高度可定制的药物平台,在肿瘤、自身免疫疾病和感染性疾病的治疗中发挥着不可替代的作用。
本文将带你快速了解抗体的结构、分类及ADCC、ADCP 及 CDC三大杀伤机制,掌握抗体药物的核心功能与研发价值。
抗体简介
抗体(Ab),又称免疫球蛋白(Ig),属于免疫球蛋白超家族的大型蛋白质,能够识别并结合特定的抗原,是机体抵御外来抗原的重要武器。
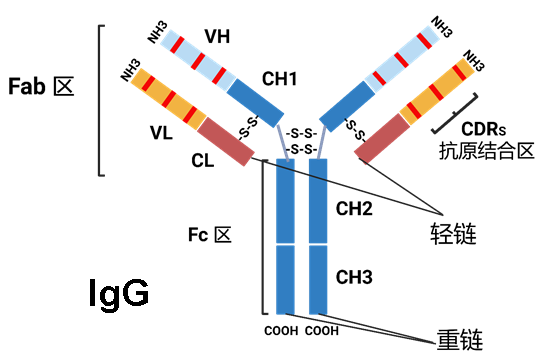
抗体的基本结构为Y形球状蛋白,由四条多肽链组成:两条轻链和两条重链,并通过二硫键连接。
每条重链和轻链各含一个可变区(V)和一个恒定区(C),结构域分为 Fab 区和 Fc 区,其中 Fab 区负责抗原识别,而 Fc 区则通过与免疫细胞受体或补体系统相互作用,介导抗体的效应功能。[2]
抗体分类
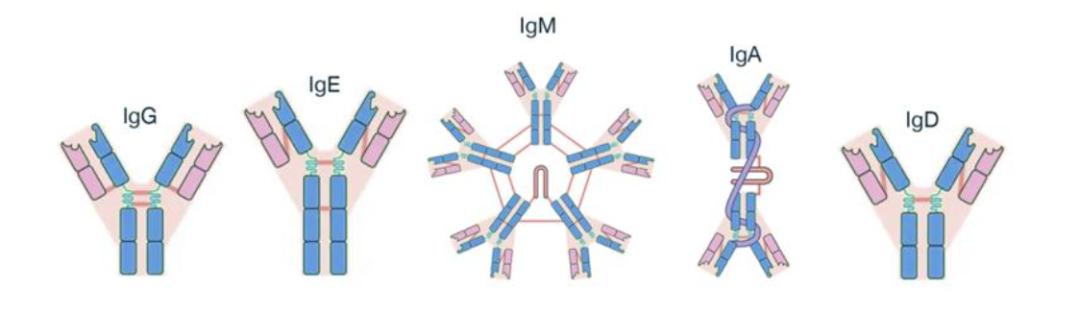
依据H链恒定区结构的不同,一般将免疫球蛋白分为IgG、IgM、IgA、IgD和IgE五类。其中IgG在人体内含量最高,具有较长的半衰期,也是当前抗体药物设计的主要结构基础。
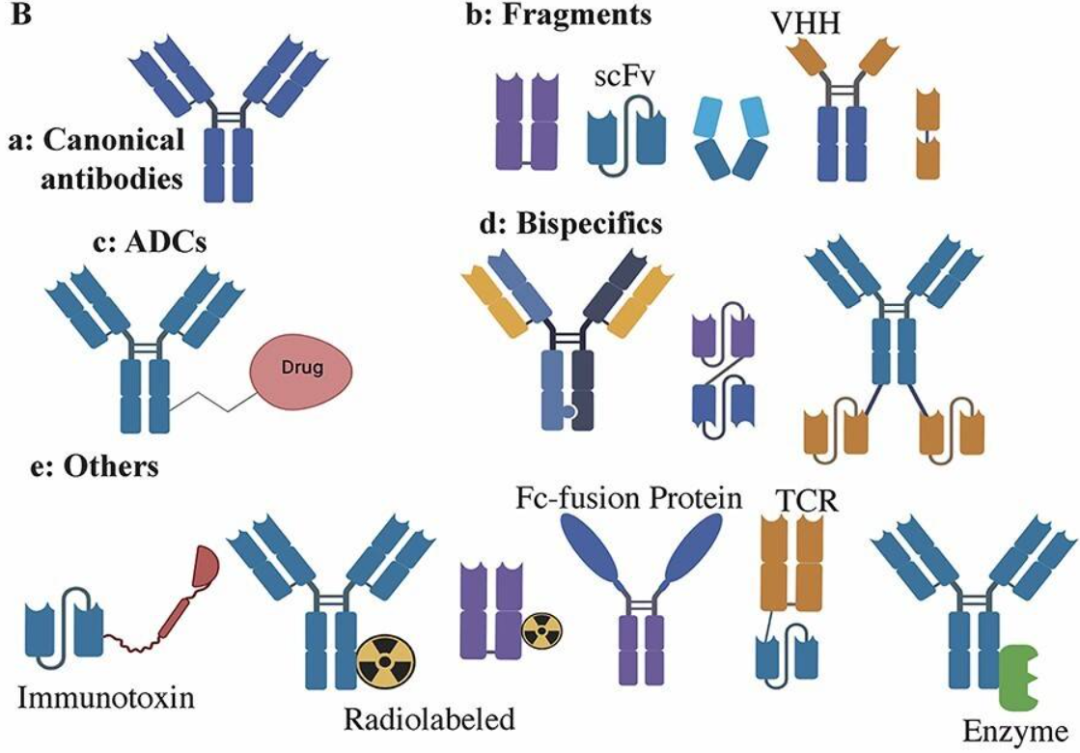
依据是否保留 Fc 结构以及其工程目的/功能,IgG 及其衍生物在文献中常被分为多种形式:典型全长 IgG、抗体片段(Fab、scFv 等)、双/多特异性抗体(IgG-like 与非 IgG-like 格式)、抗体-药物偶联物(ADC)、以及 Fc-融合蛋白与其它免疫偶联体等。如下图所示:
a. 典型全长 IgG(canonical IgG);
b. 片段抗体:包括Fab片段、单链变异片段(scFv)、Fc片段等
c. 抗体药物偶联物(ADCs):与细胞毒性小分子药物载荷结合的单克隆抗体;
d. 双特异性抗体:包括异二端双特异性抗体、scFv–scFV双特异性抗体,如双特异性T细胞增殖剂(BiTE)和基于IgG-scFv的四价抗体; 双特异性/多特异性抗体(IgG-like 或非 IgG-like 格式)
e. 其他:包括抗体结合免疫毒素、放射性标记的典型抗体、放射性标记的Fab片段、Fc融合蛋白(如受体-Fc、细胞因子-Fc 等)、与可溶性T细胞受体(TCR)融合的scFv,以及与酶融合的IgG
抗体三大作用机制
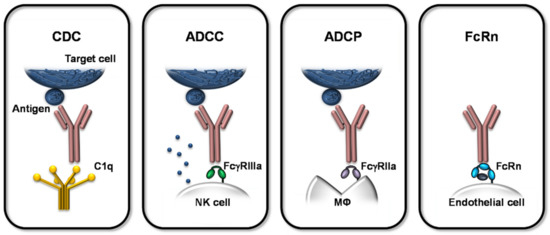
抗体的免疫清除功能体现在多个层面。除抗原结合能力外,其Fc段所介导的效应功能至关重要。其中,抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬(ADCP)以及补体依赖性细胞毒性(CDC)是抗体发挥功能的三大作用机制[3]。
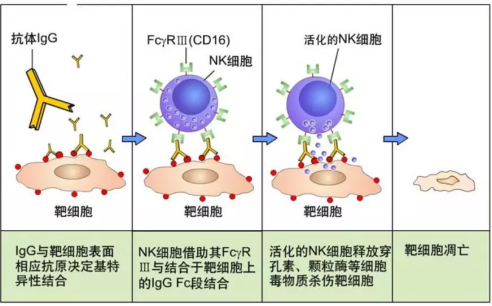
ADCC
指抗体的Fab段与病毒感染细胞或肿瘤细胞表面的抗原表位结合,其 Fc 段进一步与效应细胞(如 NK 细胞、巨噬细胞、中性粒细胞等)表面的 Fc 受体结合,从而介导效应细胞直接杀伤靶细胞。是抗肿瘤的治疗性抗体药物发生作用的一种重要机制之一。
ADCC 由效应细胞、抗体和靶细胞三部分构成,可与 IgG 结合的主要 Fc 受体包括 FcγRI(CD64)、FcγRII(CD32)和 FcγRIIIa(CD16)。
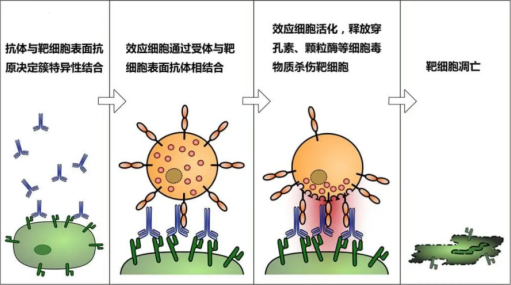
ADCP
与ADCC不同,ADCP 由表达 FcγRIIa(CD32a)、FcγRI(CD64)和 FcγRIIIa(CD16a)的单核细胞、巨噬细胞、嗜中性粒细胞和树突状细胞介导吞噬疾病细胞。阻断研究显示 ,FcγRIIa 是主要发挥作用的受体。
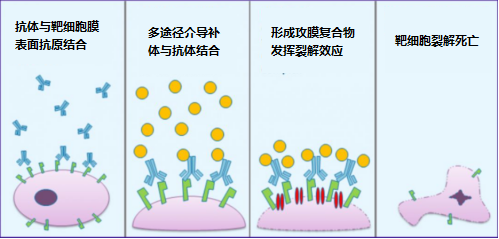
CDC
补体是一组存在于哺乳动物血清和组织液中的不耐热可溶性蛋白与膜结合蛋白,经活化后具有酶活性,共包含 30 余种成员。在 CDC 过程中,抗体首先与补体 C1q 结合,随后激活 C2–C9,形成膜攻击复合物(MAC),从而裂解靶细胞。多种抗肿瘤抗体可介导 CDC 作用,如抗 CD20、CD52 和 CEA 等抗体。
治疗性单克隆抗体Fc介导效应概述
综上,抗体的 Fc 段不仅决定 ADCC、ADCP 和 CDC 等核心功能,还影响与补体、各类 FcγR 以及 FcRn 的相互作用,从而调控抗体的效应活性和体内半衰期。因此,围绕 Fc 区的功能优化已成为抗体研发的重要方向。
Fc工程化改造
Fc 工程化改造能够赋予抗体药物更强的肿瘤杀伤能力和免疫激活能力,近年来成为抗体药物研发的重要研究方向。主要改造策略包括:
一、C1q介导的 CDC 改造
抗体 Fc 段可与 C1q 的六个球形头部结合,启动血清中补体蛋白的水解级联反应,产生炎症介质 C3a、C5a,并在靶细胞表面形成膜攻击复合物(MAC),最终诱导 CDC[6]。
通过对 Fc 的 N297 残基进行糖基化修饰,可以增强 Fc 与 FcγR 及 C1q 的结合稳定性,从而提升 CDC 活性[7]。
在自身免疫性疾病的研究中,通过引入 L234F/L235E/P331S 突变并去除糖基化,可有效降低 FcγR 的亲和力,从而抑制 CDC[8]。
二、FcγR 介导的ADCC / ADCP 改造
在 FcγR 介导的ADCC和ADCP方面,Fc 与激活性 FcγR 的结合能力直接影响抗体的效应功能[9]。
通过氨基酸突变和糖基化修饰,可实现 ADCC 和 ADCP 的功能优化。具体而言,去除 Fc N297 位岩藻糖可以改善 Fc 与 CD16A 的空间结合构象,从而显著提升 ADCC 效能[10]。
此外,S239D/A330L/I332E 突变已被证实能够增强 ADCC 功能,而 VLPLL 方案(L235V/F243L/R292P/Y300L/P396L)则可提高 Fc 与 FcγR 的选择性结合,进一步优化抗体效应活性[11]。
三、FcRn介导的抗体半衰期延长
在抗体半衰期延长方面,Fc 与 FcRn 的结合呈 pH 依赖性,通过回收循环中的 IgG,可有效延长抗体在体内的循环时间,提升药物暴露和临床疗效[12]。这一策略在药物开发中具有重要意义,可为抗体药物提供稳定的体内浓度,支撑长期治疗方案。
四、FcγRIIB 调控
FcγRIIB 是唯一抑制性 FcγR,其表达可影响抗体疗效[13]。
通过 Fc 工程化提高激动性抗癌抗体与 FcγRIIB 的结合力,可优化抗体活性并调节免疫响应[14]。
用心做好细胞,为更好的靶向药
综上所述,Fc 工程化改造通过优化 CDC、FcγR 介导的 ADCC/ADCP 以及 FcRn 调控的抗体半衰期,为抗体药物研发提供了强大的技术支持。
吉满生物紧跟这一前沿趋势,推出覆盖 ADCC、ADCP 及 FcRn相关的细胞系、抗体现货产品及定制服务,满足药物研发及临床申报需求。(详情咨询吉满客服:18916119826)此处点击了解 ADCC/ADCP /FcRn相关产品
此外,吉满生物拥有HEK293、Jurkat E6.1、CHO-K1细胞商业化使用授权,同时拥有HEK293细胞中国内地定向用途分授权独家代理,提供合规性授权解决方案。为客户早期研发到产品上市保驾护航。

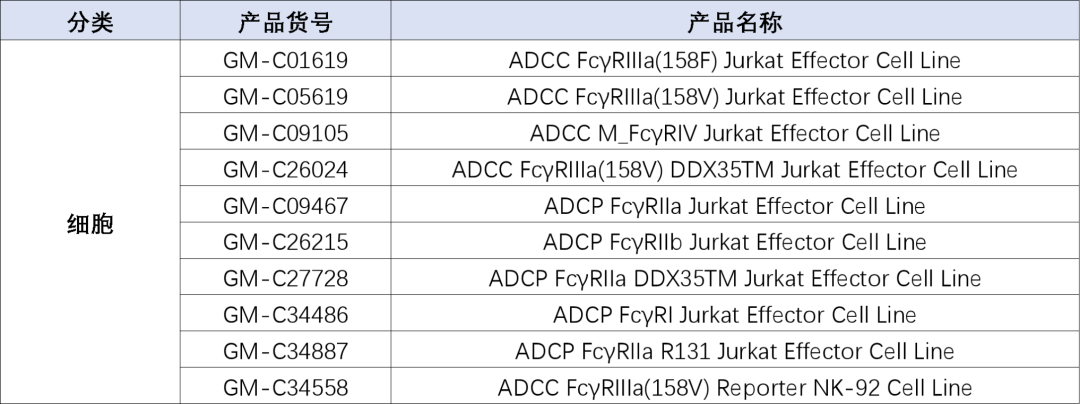
产品列表
数据展示(部分)
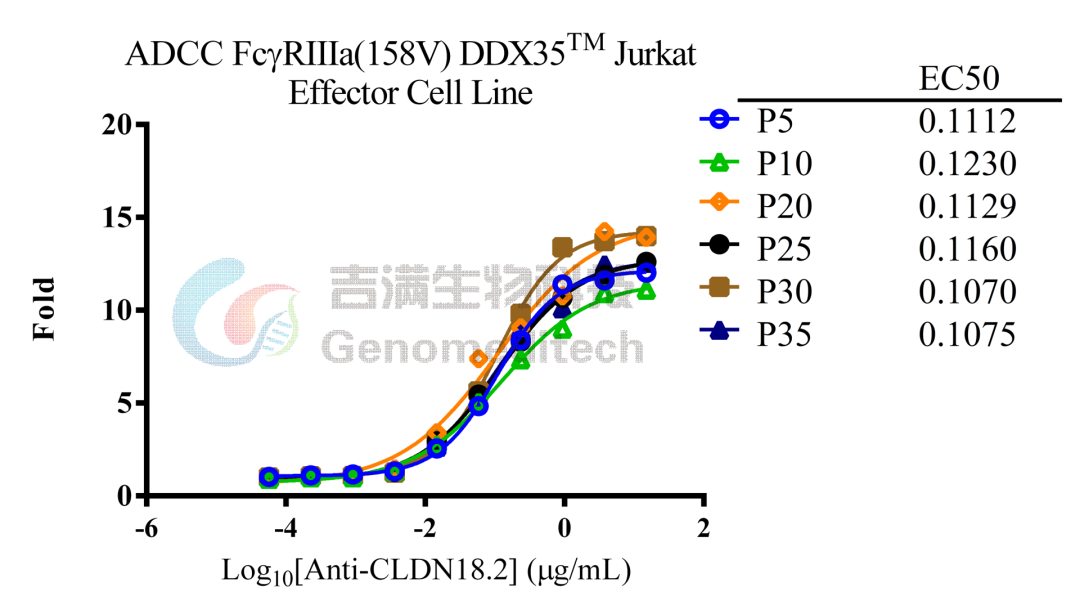
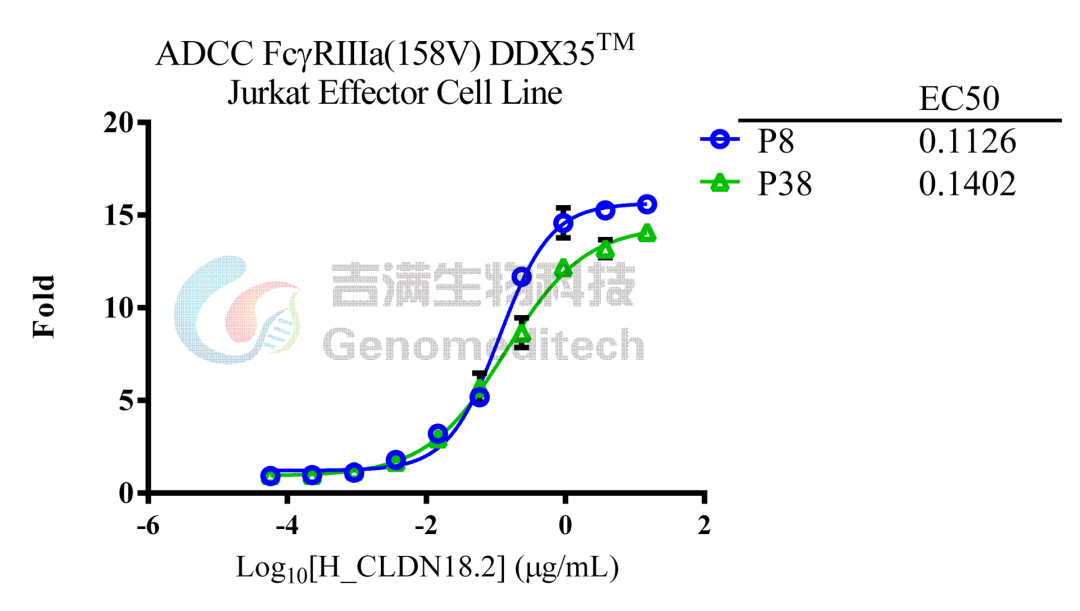
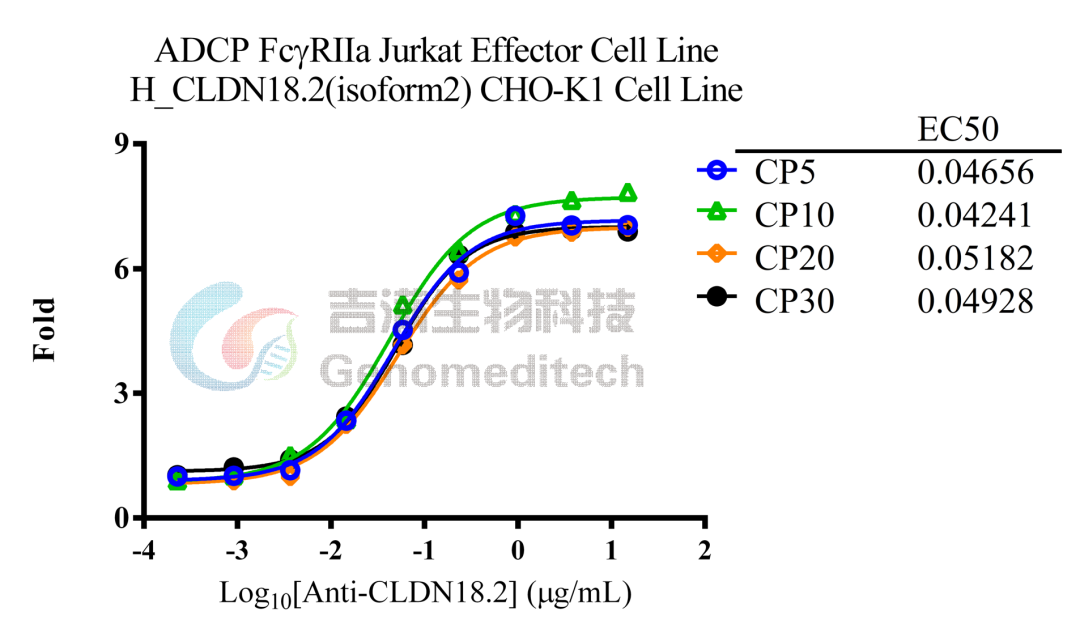
吉满生物细胞系产品经过多次传代验证仍稳定表达,助力抗体筛选、表征及一致性评价。
GM-C26024:ADCC FcγRIIIa(158V) DDX35™ Jurkat Effector Cell Line
使用Anti-CLDN18.2 hIgG1 Antibody稳定性验证结果
使用Anti-CLDN18.2 hIgG1 Antibody验证结果
GM-C09467:ADCP FcγRIIa Jurkat Effector Cell Line
使用Anti-CLDN18.2 hIgG1 Antibody稳定性验证结果
经抗体验证,该细胞系产品表达稳定可靠,为FcRn靶点研究、抗体筛选及机制解析提供高质量实验工具。
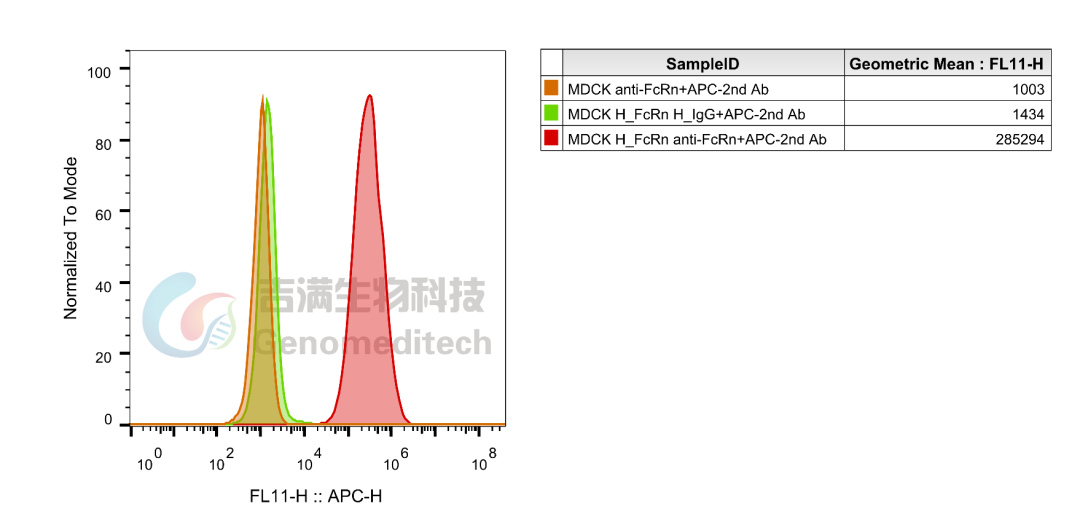
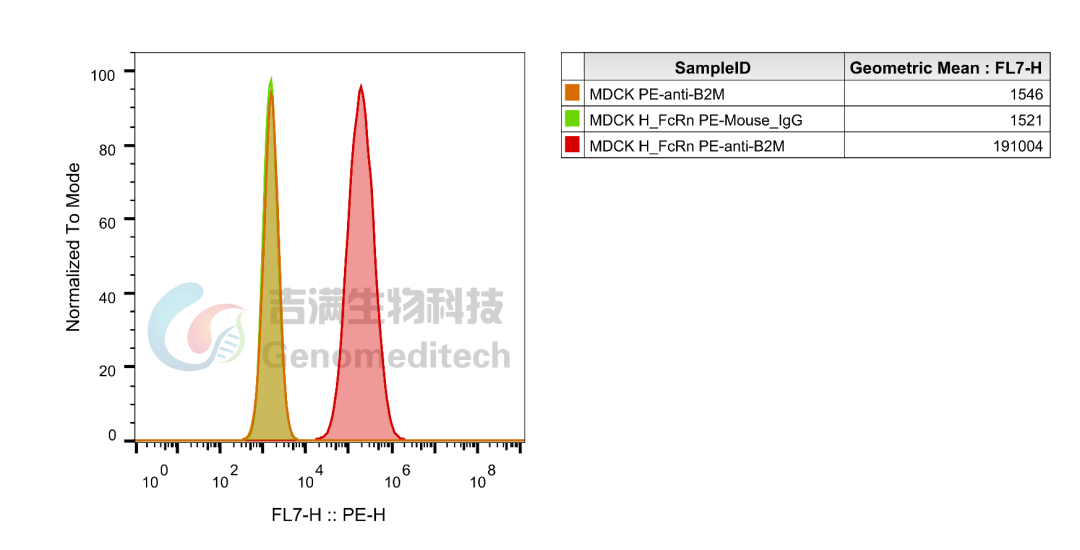
GM-C39432:H_FcRn MDCK Cell Line
使用Anti-FcRn hIgG4 Reference Antibody (Rozabio) 验证结果
使用PE anti-human β2-microglobulin Antibody验证结果
联系我们
吉满生物专注为生物药开发,提供高效的研发工具和解决方案。截止当前已布局近400个热门靶向药靶点,超1000株现货单克隆细胞系,涵盖肿瘤相关抗原(TAA)、 免疫检查点、Fc受体、细胞因子和激酶等热门靶点类型。旨在助力、加速大分子早期研发,做到进口细胞的国产替代。同时构建了丰富的蛋白、抗体及试剂现货产品库。
参考文献:
[1].Allergy Clin Immunol. 2010 Feb; 125(202): S41–S52.doi: 10.1016/j.jaci.2009.09.046
[2].https://sciencenotes.org/types-of-antibodies-and-their-functions/
[3].Lyu X, Zhao Q, Hui J, Wang T, Lin M, Wang K, Zhang J, Shentu J, Dalby PA, Zhang H, Liu B. The global landscape of approved antibody therapies. Antib Ther. 2022 Sep 6;5(4):233-257. doi: 10.1093/abt/tbac021. PMID: 36213257; PMCID: PMC9535261.
[4].Gogesch, P.; Dudek, S.; van Zandbergen, G.; Waibler, Z.; Anzaghe, M. The Role of Fc Receptors on the Effectiveness of Therapeutic Monoclonal Antibodies. Int. J. Mol. Sci. 2021, 22, 8947. https://doi.org/10.3390/ijms22168947
[5] Jefferis R. Antibody Fc engineering for enhanced effector functions. MAbs. 2012;4(3):346–356.
[6] Nimmerjahn F, Ravetch JV. Fcγ receptors as regulators of immune responses. Nat Rev Immunol. 2008;8(1):34–47.
[7] Diebolder CA, et al. Complement-activating IgG hexamers. PNAS. 2014;111(26):E 2491–2500.
[8] Shields RL, et al. High-resolution mapping of FcγR binding. J Biol Chem. 2001;276:6591–6604.
[9] Wang X, et al. Fc engineering to improve ADCC/ADCP. Trends Biotechnol. 2018;36:634–649.
[10] Ferrara C, et al. Glycoengineering of antibodies for enhanced ADCC. Nat Biotechnol. 2011;29:300–305.
[11] Lazar GA, et al. Engineered antibody Fc variants with improved effector function. PNAS. 2006;103:4005–4010.
[12] Datta-Mannan A, et al. FcRn and IgG pharmacokinetics. mAbs. 2010;2:383–390.
[13] Nimmerjahn F, Ravetch JV. FcγRIIB in immune regulation. Curr Opin Immunol. 2006;18:245–252.
[14] Chu SY, et al. FcγRIIB engineering for agonistic antibodies. MAbs. 2020;12:1787475.