研发工具
肿瘤治疗的演进,本质上是一场针对“精准”与“高效”的极致求索。当传统疗法在疗效与安全性之间难以突破瓶颈时,抗体偶联药物(ADC)凭借其精巧的“生物导弹”设计,成为重塑肿瘤治疗格局的关键力量。
ADC药物由三个关键部分组成:特异性抗体、连接子和细胞毒性药物。这三个组分的优化组合决定了ADC药物的最终疗效和安全性。
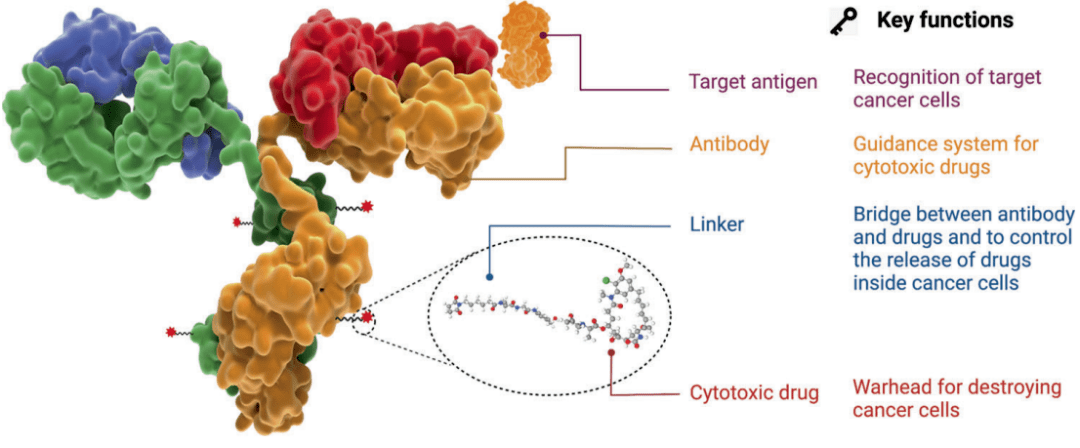
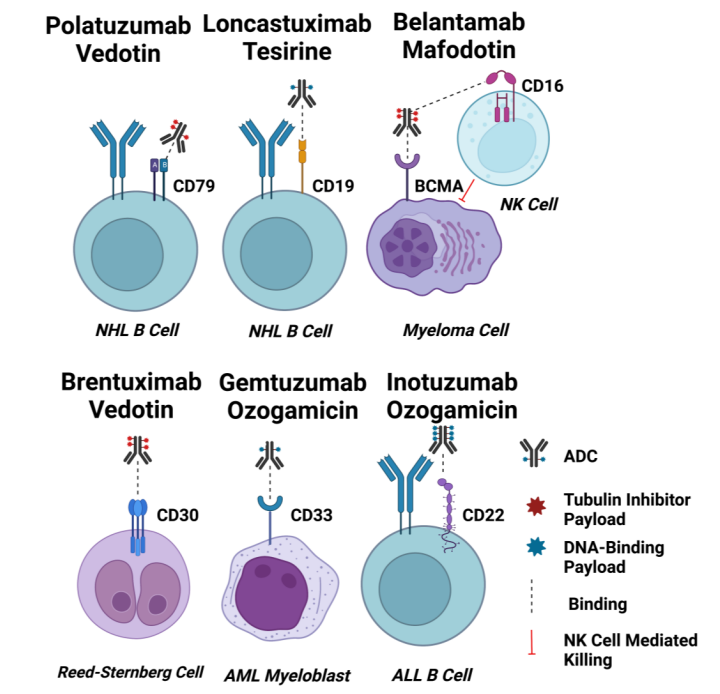
ADC药物的结构和功能[1]
抗体 充当“导航系统”,能够精准识别肿瘤细胞表面的特定抗原,并将整个药物分子引导至肿瘤细胞。
连接子则是关键的“稳定器”,在血液循环中保持药物稳定,当药物到达目标位置后才释放细胞毒性药物。
细胞毒性药物是ADC的“弹头”,通常是高效的小分子药物,能够破坏癌细胞的DNA或微管结构,导致细胞死亡。
ADC药物设计的多维度验证
凭借其精准的靶向递送机制,ADC药物在肿瘤治疗领域展现出巨大的临床潜力和商业价值。
但若想走向临床转化,多维度验证是不可缺少的环节。这不仅是对药物分子设计科学性的检验,更是降低临床风险、提高成药性的关键保障。
靶点选择
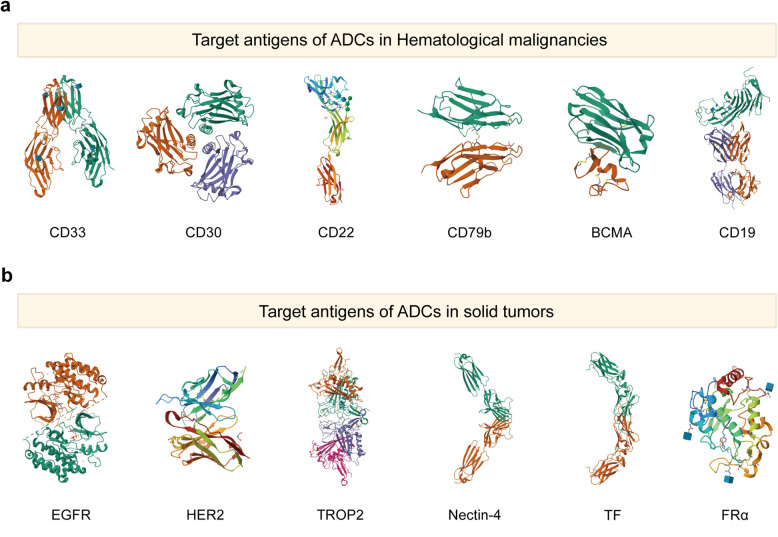
靶点选择是ADC设计的首要环节。理想靶点应在肿瘤细胞高表达,而在正常组织中低表达或不表达,以限制脱靶毒性。
当前ADC药物研发的“明星靶点”包括HER2、TROP2、Nectin-4、FRα、EGFR、BCMA、CD家族(CD33、CD30、CD22、CD79B、CD19)等。
此外也涌现出许多备受关注的新兴靶点,如B7-H3、c-MET、DLL3、ROR1、CLDN18.2、CDH17等,正在为更精准治疗不同类型癌症开辟新道路。
靶抗原应该是非分泌性的,以尽量减少与游离单克隆抗体的非特异性结合,这可能会损害ADC定位的准确性和安全性。
ADC药物的靶抗原[3]
与此同时,选择具有强大内吞能力和适当转运途径的靶点对于确保ADC的有效内化和增强药物的细胞毒性作用至关重要。
抗体筛选
抗体筛选阶段,需要对候选抗体的抗原特异性、亲和力、内化效率以及在肿瘤组织中的靶向性进行严格验证,确保其能精准识别并结合靶抗原,为后续有效载荷的递送奠定基础。
连接子的稳定性
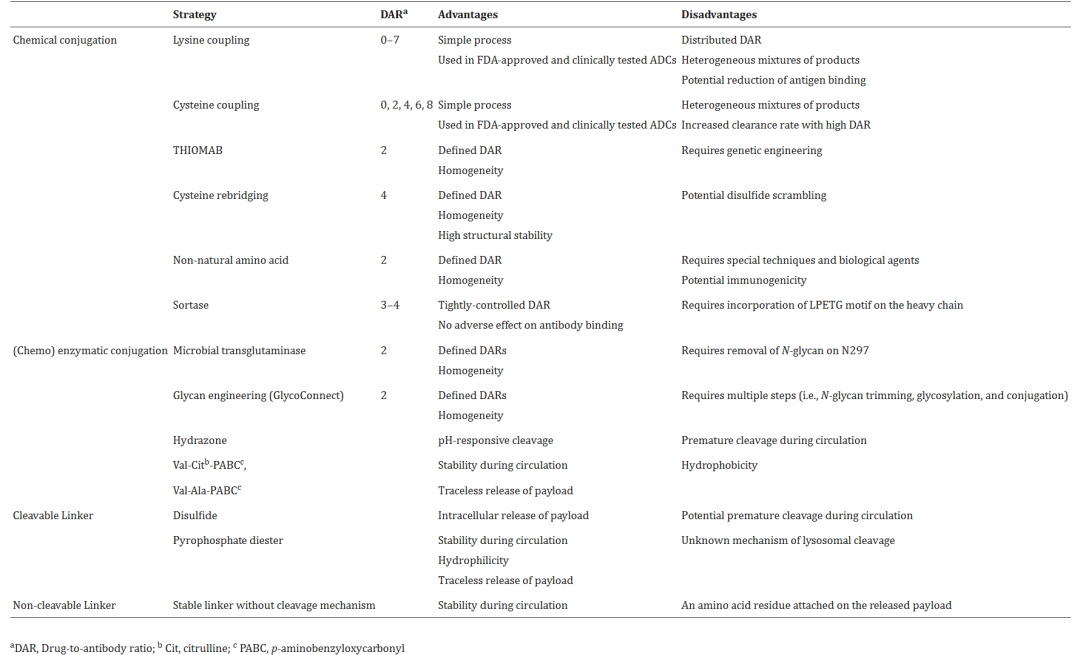
连接子(linker)的稳定性直接影响药物安全性。
连接子通常分为两种主要类型:可切割的和不可切割的。过于稳定的连接子可能影响药物释放,而不稳定的连接子会导致过早释放毒素,引起毒副作用。
此外,根据有效载荷的特征优化的具有适当亲水/亲油性质的连接子可以在避免ADC聚集的同时减轻免疫反应[4]。
不同类型连接子的优缺点[4]
内化效率评估
影响内化效率的主要因素包括靶抗原的密度和分布、抗体与抗原的亲和力、抗体结合的表位特征以及细胞内吞通路的效率。研究表明,即使针对同一靶点,不同抗体的内化效率可能存在显著差异,这直接影响ADC药物的效力。
细胞毒性药物(payload)的效能验证
不仅包括其细胞毒性强度,更要关注其与抗体、linker的匹配性,以及释放后在细胞内的有效分布和杀伤机制。
假设抗体药物偶联物(ADC)机制中每个步骤的效率均为 50%(生物分布、与抗原结合、内化、有效载荷释放、有效载荷的细胞内稳定性以及有效载荷与靶点结合),那么只有 1.56% 的给药分子能够进入靶细胞[5]。
小 结
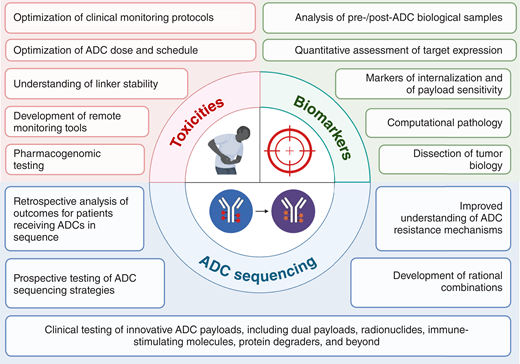
ADC药物发展的主要挑战和潜在解决方案[6]
专注为生物药开发
提供高效的研发工具和解决方案
依托对前沿靶点的敏锐洞察以及在ADC药物研发领域多年的技术积累与经验沉淀,吉满生物开发了一系列产品和服务,全面助力客户评估ADC候选药物的潜在成药性,加速ADC药物的研发进程。
一、靶抗原稳定表达细胞系
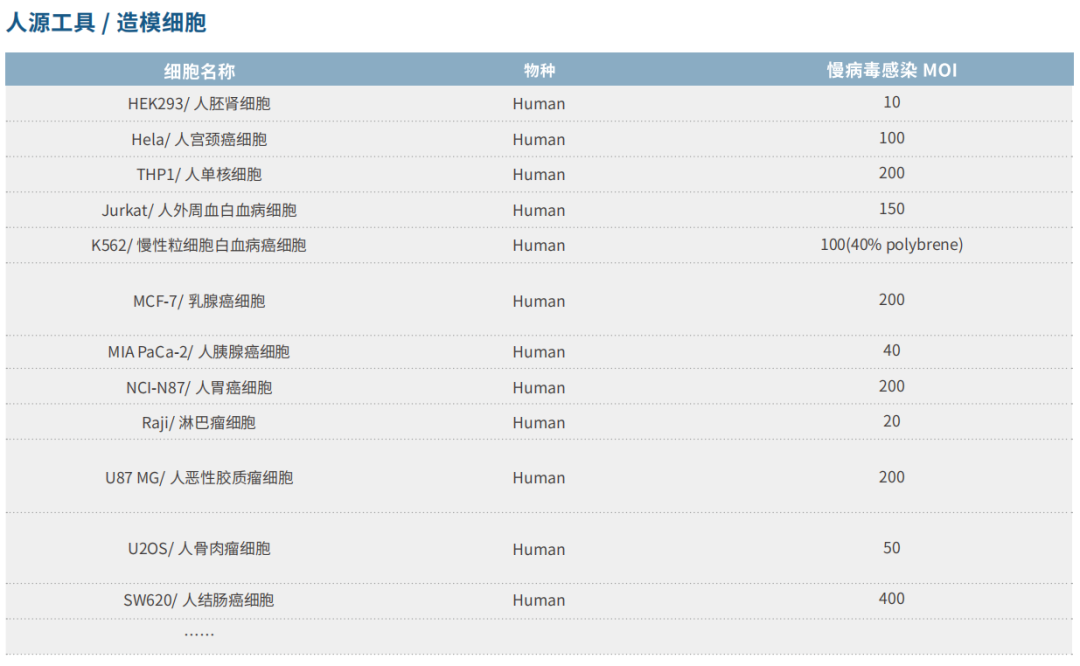
吉满生物深度布局STEAP1、DLL3、CDH17、HER2、TROP2、Nectin-4、FRα、EGFR、BCMA、CD家族、PTK7等热门靶点,提供上百株稳定表达细胞系。
产品优势
靶点高表达:吉满生物构建的靶抗原稳定表达细胞系能确保ADC候选分子在体外实验中充分结合,同时避免了因靶点表达量过低而导致的假阴性结果。
稳定性强:构建完成的细胞系经过严格流式细胞术筛选和验证,其表面抗原表达均一、稳定,在长期传代过程中仍能保持稳定的靶点呈现,降低因细胞株不稳定带来的结果误差。
背景纯净:采用严谨的筛选方法,有效排除内源性靶点干扰及其他无关蛋白的交叉反应,确保细胞系背景清晰,使抗体与靶点的结合检测及杀伤效应等研究结果更具特异性和准确性。
质量可控:每一株细胞系均提供完整的质量控制报告,涵盖靶点表达验证数据、细胞活力、无菌检测结果等关键信息,满足药物研发过程中对实验材料可追溯性和标准化的要求。
应用广泛:此类细胞系适用于ADC药物的靶点验证与筛选、肿瘤杀伤能力测试以及CMC质控等多个阶段。
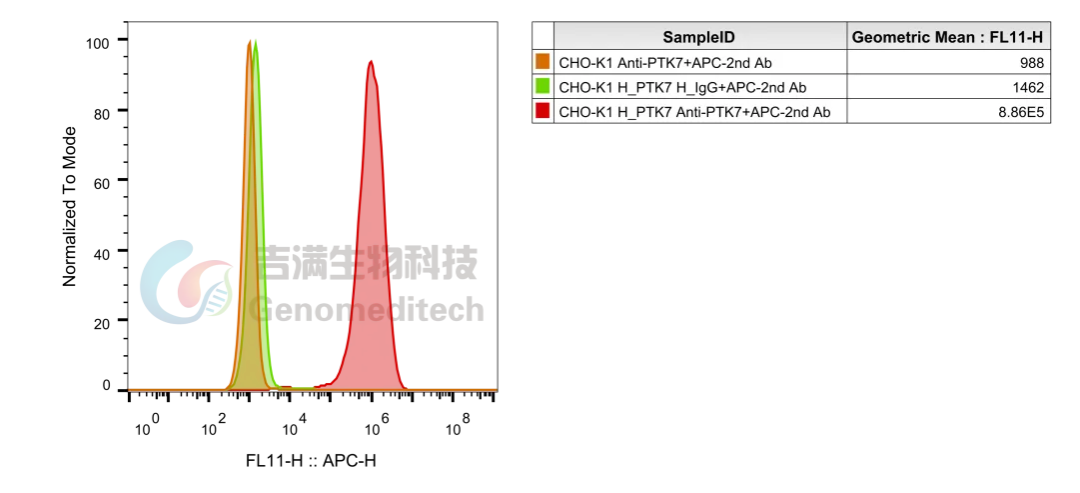
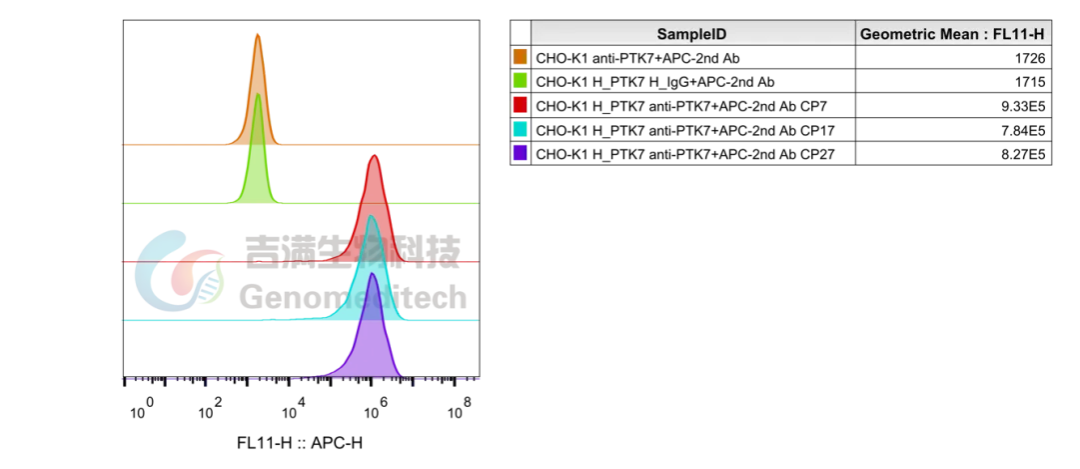
以新兴靶点PTK7为例,该靶点在结肠癌、胃癌、肺癌和急性髓系白血病中mRNA水平显著升高,在ADC药物开发中极具潜力。
吉满所构建的PTK7稳定表达细胞株可提供纯净背景,用于验证抗体与靶点的结合特异性和亲和力,为ADC药物早期研发阶段的靶点验证和药效筛选提供稳定可靠的“细胞级”研究工具。
数据展示
表达H_PTK7的CHO-K1细胞株流式检测结果
表达H_PTK7的CHO-K1细胞株稳定性验证结果
二、抗体效应功能评价细胞系
ADC药物的抗体部分(mAb)不仅是递送细胞毒性药物的“导航系统”,其本身介导的免疫效应也是抗肿瘤活性的关键组成部分。
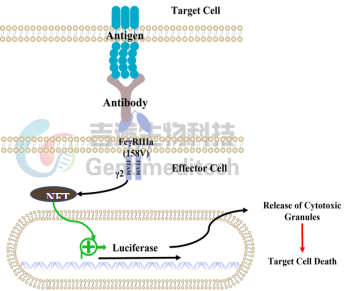
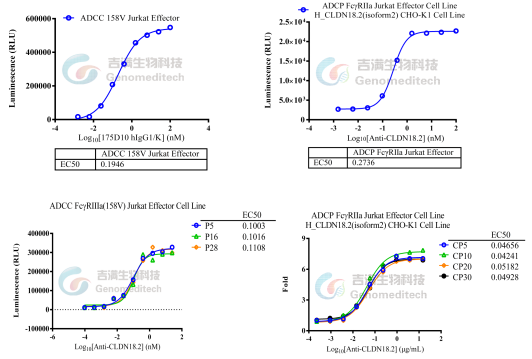
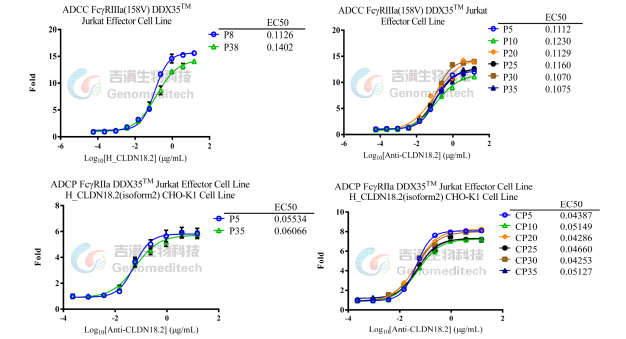
吉满生物构建了ADCC/ADCP报告基因检测细胞系,采用高度工程化的Jurkat/HEK293/CHO-K1/MDCK等细胞作为效应细胞模型,并稳定表达了Fcγ受体和由NFTA应答应答元件驱动表达的萤火虫萤光素酶,其中ADCC细胞系主要表达NK细胞上的FcγRⅢa,ADCP细胞系主要表达巨噬细胞上的FcγRIIa。
ADCC/ADCP报告基因检测细胞系设计图
相关阅读:一文读懂抗体:结构、分类与ADCC/ ADCP/ CDC机制
数据展示
ADCC/ADCP报告基因检测细胞系功能表征与代次稳定性验证
此外,吉满生物还提供传代稳定性高达35代的放行级ADCC/ADCP报告基因检测细胞系,该放行级细胞系同样经过严格的质量控制,可直接用于药物研发的临床前评价阶段。
放行级ADCC/ADCP报告基因检测细胞系
功能表征与代次稳定性验证
三、DT3C蛋白
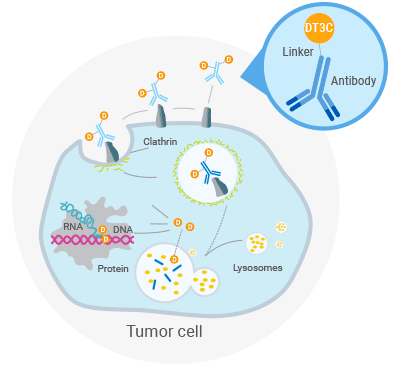
DT3C 是重组表达的融合蛋白,由白喉毒素的Fragment A (仅毒素部分)和G 群链球菌的3C片段(lgG 结合部分)融合而成。
该蛋白能够与单克隆抗体(mAb)的Fc 端高度亲和,与mAb结合的DT3C分子在抗体被内吞时一同进入细胞,在胞内弗林蛋白酶(furin protease)的作用下,释放出具有毒性的DT,DT能够抑制EF2-ADP 核糖基化的活性,阻断蛋白翻译过程,最终导致细胞死亡,而未进入细胞的DT3C 则不具有杀伤细胞的活性。因此可根据细胞杀伤情况来评价ADC药物的内化效率。
DT3C介导的细胞杀伤机制
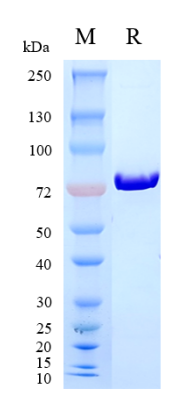
吉满生物重组DT3C 蛋白 (Cat.GM-046001RP)从大肠杆菌中(E.coli)表达,包含33-417aa (P00588) & 291-497aa (P19909),8His标签序列置于DT3C编码序列的N端,纯度≥90% (SDS-PAGE),分子量69.4 kDa,溶解在pH7.4的PBS中,经过0.2 μm过滤膜除菌,内毒素< 1EU/μg。点击了解DT3C 相关产品
产品优势
使用简便:在室温下孵育30min即可形成mAb-DT3C偶联物。该共轭物可直接加到完全培养基的细胞中进行孵育。
多物种适用:可与来自不同物种(如人、小鼠、兔、山羊)的任何IgG结合。
检测便捷:通过流式细胞术或荧光显微镜等方法,即可快速、准确地检测ADC药物在细胞表面的内化效率。
内化效率高:分子量小于Mab-ZAP,mAb-DT3C内化效率高于mAb-Mab-ZAP。
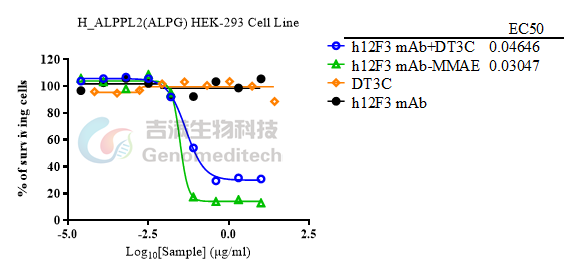
数据展示
细胞内化实验(h12F3 mAb与 DT3C的摩尔比为1:6、细胞量3×103 Cells/孔,除DT3C以外,横坐标为抗体的浓度)
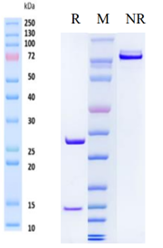
经SDS-PAGE验证,吉满DT3C蛋白纯度高于90%
四、ADC靶抗原蛋白
在ADC药物开发中,靶抗原蛋白是确保药物精准识别肿瘤细胞的核心基础。吉满生物凭借前沿的重组蛋白技术平台,提供覆盖热门靶点与新兴靶点的高质量靶抗原蛋白产品,为ADC药物的抗原结合活性验证、并行筛选、药代动力学研究等提供关键工具。
ADC靶抗原蛋白
产品优势
高纯度:经SDS-PAGE验证,纯度>95%。
高生物活性:经ELISA结合活性检测,批间一致性偏差<10%。
严格质控:所有步骤严格遵循ISO9001质量管理体系,提供无菌性、内毒素、稳定性等详细质检报告。
种类丰富:覆盖人、鼠、食蟹猴等多种物种以及多种蛋白标签,支持个性化定制。
天然构象:采用HEK293等真核表达系统生产,支持正确折叠与翻译后修饰,极大程度保留靶抗原蛋白的天然构象与生物学特性。
数据展示
生物素标记的人Nectin-4蛋白(带有His-Avi标签)
纯度与活性检测
带His标签的人TROP2蛋白用于抗体结合活性比较分析
五、ADC类抗体
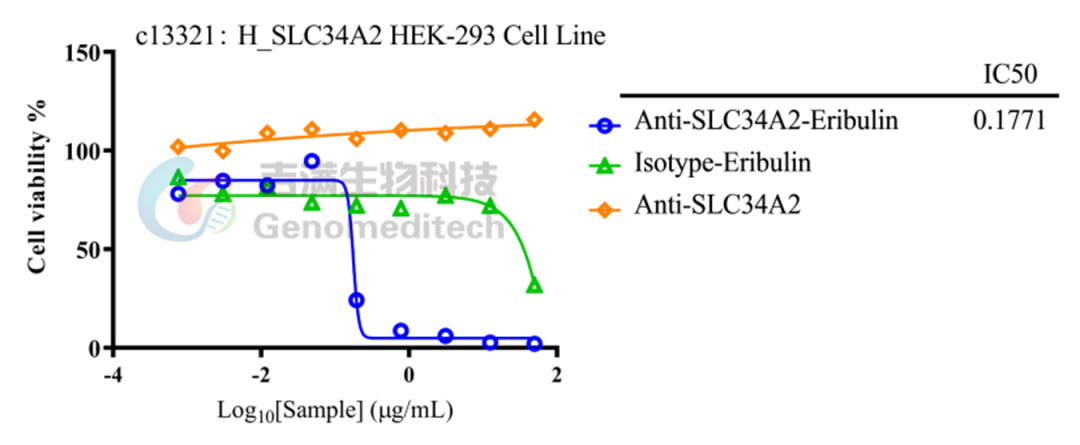
在ADC药物研发过程中,准确评估药代动力学(PK)特性至关重要。吉满生物可提供涵盖抗MMAE、Dxd、Eribulin等热门毒素的抗毒素抗体(抗payload抗体)及配套的ADC对照抗体。这些产品直接服务于ADC药物的PK分析,帮助研究人员更精准地测定药物在体内的暴露水平、代谢速率及清除途径等,为药物的剂量优化、安全性评价和有效性验证提供关键的数据支持。
产品优势
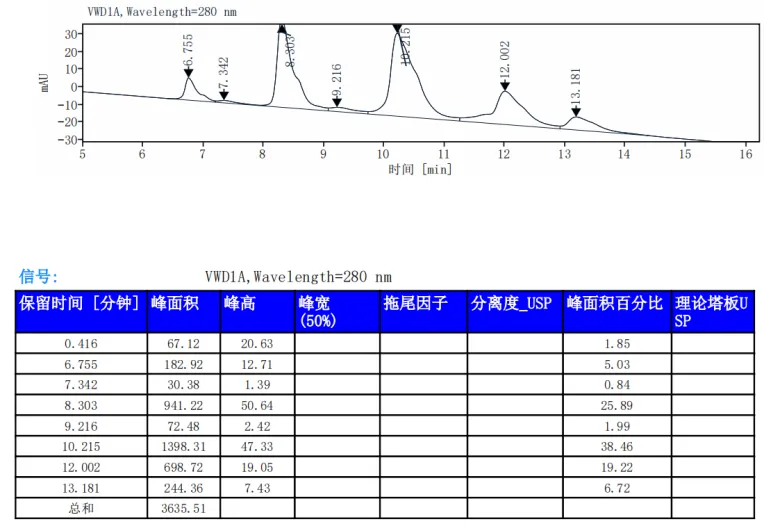
纯度高:经SDS-PAGE及SEC-HPLC验证纯度>95%。
高特异性和亲和力:能够有效识别并结合游离的毒素或ADC药物分子,避免交叉反应对检测结果的干扰。
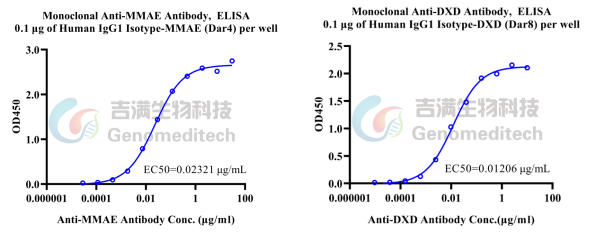
高灵敏度:EC50/IC50值可达纳克每毫升级别。
数据完善:提供完善的PK验证数据参考。
数据展示
ELISA验证抗毒素抗体活性
抗MMAE抗体高灵敏度结合MMAE
/抗DXD 抗体高灵敏度结合DXD
经SDS-PAGE及SEC-HPLC验证抗体纯度>95%
细胞毒性实验
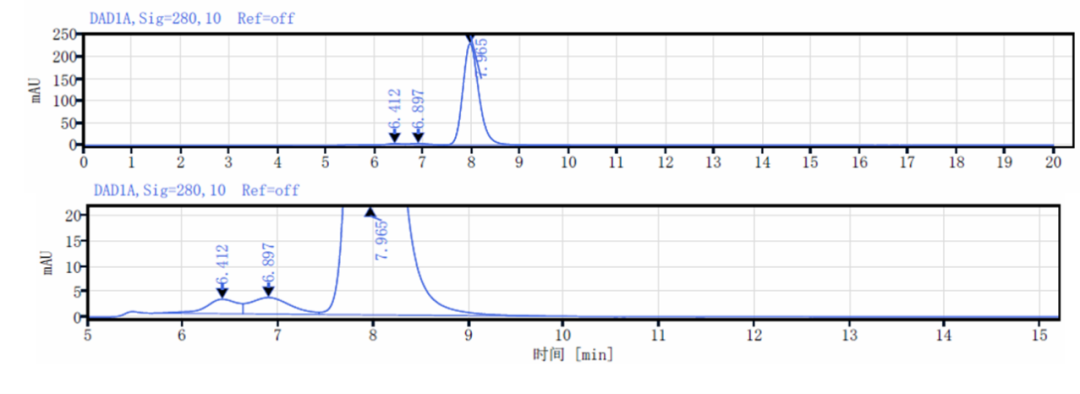
HIC-HPLC检测ADC药物抗体比
六、定制化细胞株构建
针对不同靶点的特性,吉满生物还可根据客户需求进行定制化细胞株构建,实现特定靶点在不同细胞背景下的稳定、高效表达,满足ADC药物研发过程中对多样化靶点细胞模型的需求,为精准评估ADC候选药物的靶向结合能力奠定扎实基础。
细胞授权合规性保障
吉满生物已获得HEK293、Jurkat、CHO-K1细胞商业化使用授权及HEK293中国内地定向用途独家分授权代理资格。
这意味着吉满生物基于上述细胞所开发的细胞株产品与服务在细胞授权合规性上是清晰合法的,能够全力保障客户研发中的合规性与安全性。
联系我们
如果您正在为ADC药物研发寻求稳定可靠的细胞模型支持,欢迎联系我们。无论是基础研究阶段的靶点探索,还是临床前开发阶段的药物活性筛选与优化,吉满生物都能以高质量的细胞模型产品和定制化服务,加速您的ADC药物从早期研发到后期转化的进程,共同推动更多高效、安全的ADC药物早日问世。
参考资料:
[1] Fu Z, Li S, Han S, et al. Antibody Drug Conjugate: The "Biological Missile" for Targeted Cancer Therapy. Signal Transduction and Targeted Therapy. 2022, 7(01): 93. DOI:10.1038/s41392-022-00947-7.
[2] Peters C and Brown S M. Antibody-Drug Conjugates as Novel Anti-Cancer Chemotherapeutics. Bioscience Reports. 2015: 35(04): e00225. DOI:10.1042/BSR20150089.
[3] Wang R, Hu B, Pan Z, et al. Antibody-Drug Conjugates (ADCs): Current and Future Biopharmaceuticals. Journal of Hematology & Oncology. 2025, 18(01): 51. DOI: 10.1186/s13045-025-01704-3.
[4] Tsuchikama K and An Z Q. Antibody-drug Conjugates: Recent Advances in Conjugation and Linker Chemistries. Protein & Cell. 2018, 9(01): 33-46. DOI: 10.1007/s13238-016-0323-0.
[5] Teicher B A and Chari R V J. Antibody Conjugate Therapeutics: challenges and potential. Clinical Cancer Research. 2011, 17(20): 6389-6397. DOI: 10.1158/1078-0432.CCR-11-1417.
[6] Colombo R, Tarantino P, Rich J R, et al. The Journey of Antibody-Drug Conjugates: Lessons Learned from 40 Years of Development. Cancer Discovery. 2024, 14(11): 2089-2108. DOI: 10.1158/2159-8290.CD-24-0708.