文献解析
2025年12月,华中科技大学同济医学院附属同济医院泌尿外科王少刚、夏启东教授和核医学朱小华教授团队在《International Journal of Biological Sciences》上发表重要研究 “Targeting the HSP60/p53 Axis with Extracellular Vesicle-Delivered siRNA Reprograms Glycolysis in Prostate Cancer”。
徐梦瑶、马晟、马思阳为第一作者。
关键词:前列腺癌;HSP60;p53;糖酵解;细胞外囊泡
研究背景:前列腺癌
前列腺癌(PCa)是全球男性高发恶性肿瘤,尤其是进入去势抵抗阶段后,缺乏有效靶向治疗手段。
在肿瘤研究领域,细胞代谢重编程是恶性肿瘤的十大特征之一,其中糖酵解途径的异常激活尤为关键,是恶性转化的代谢枢纽。
本研究系统揭示了热休克蛋白60(HSP60)在前列腺癌中通过调控糖酵解促进疾病进展的关键作用,并创新性地开发了一种基于细胞外囊泡(EVs)的siRNA递送系统,为前列腺癌的精准治疗提供了新策略。
项目研究
靶点鉴定与验证
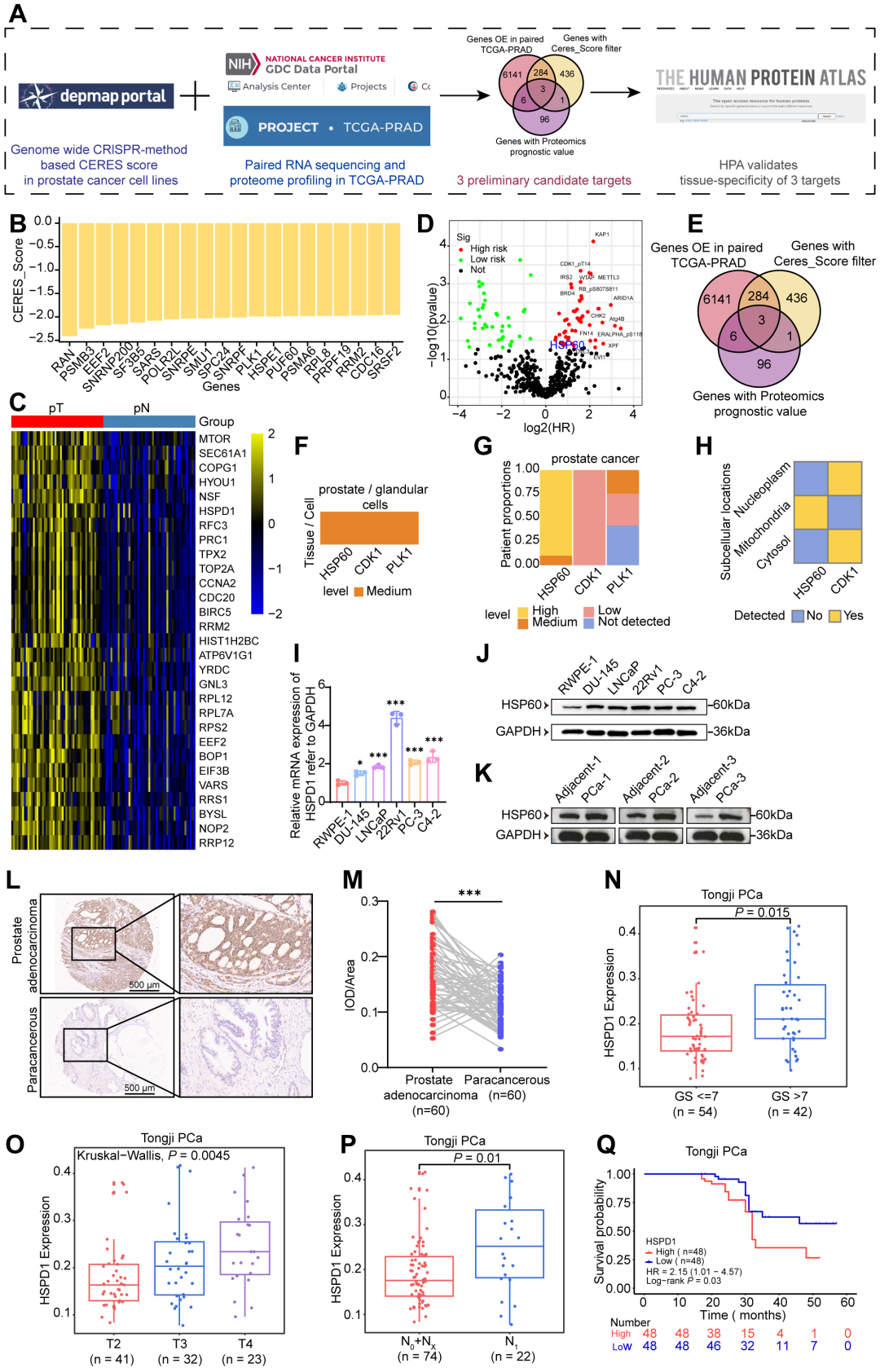
首先,利用多个公共数据库(DepMap、TCGA、HPA)筛选前列腺癌中特异性高表达的分子,多数据库整合分析锁定 HSPD1 为PCa特异性高表达基因;并在组织中验证其表达水平与患者临床特征间的联系,发现HSP60蛋白在癌组织中显著上调,且表达水平与Gleason评分、T分期、淋巴结转移及生化复发显著相关。
HSP60在前列腺癌中高表达,并与前列腺癌进展和不良预后相关
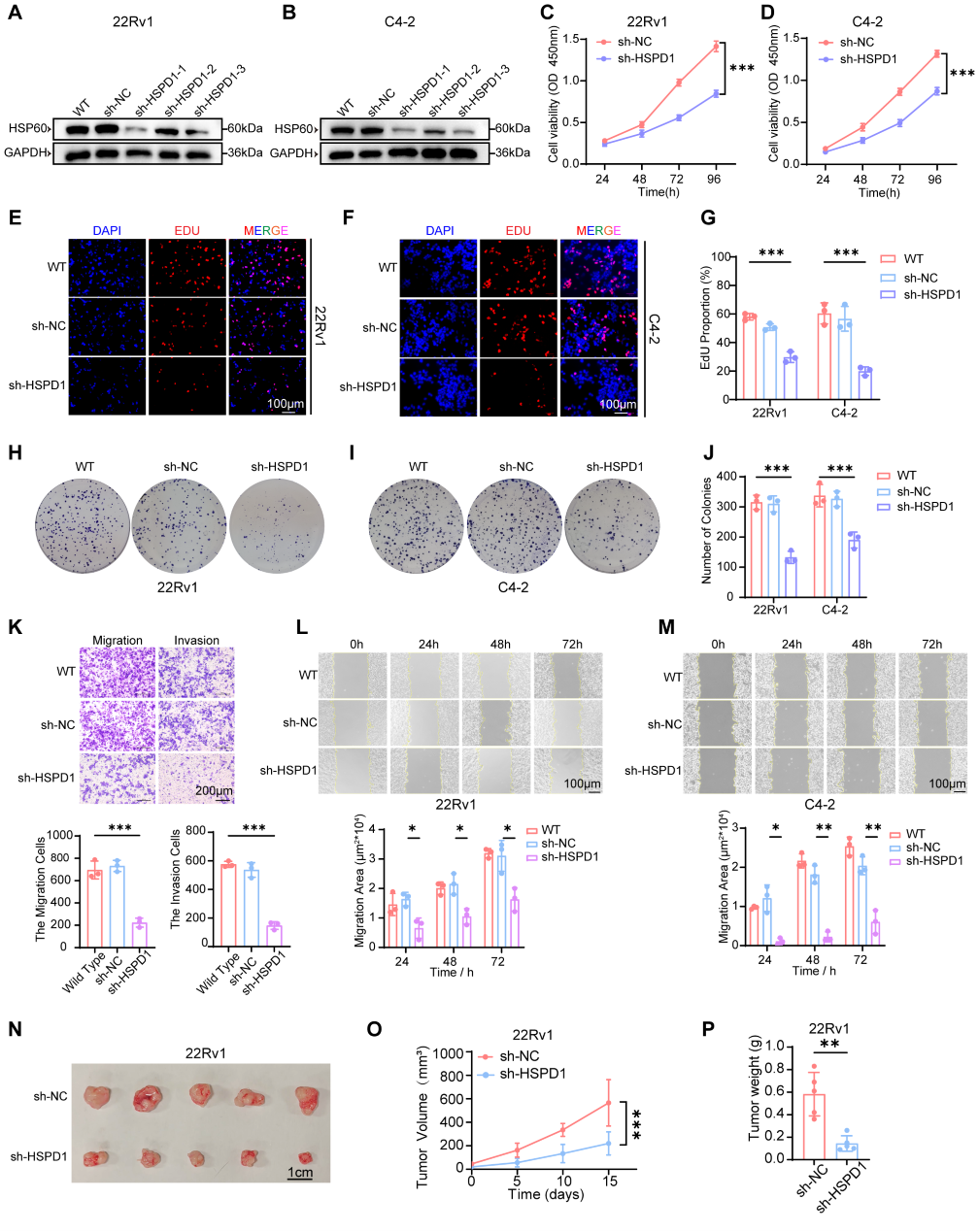
随后,通过基因敲减和过表达技术构建稳转细胞系,探究HSPD1对前列腺癌细胞增殖、转移能力的影响。体外证实HSPD1能显著促进PCa细胞增殖、迁移、侵袭及克隆形成。
再构建动物模型以探究该分子在体内对前列腺癌增殖的影响,小鼠皮下移植瘤模型进一步证明,敲低HSPD1可显著抑制肿瘤生长,而过表达则加速进展。
HSP60促进前列腺癌细胞的增殖和转移
机制深度解析
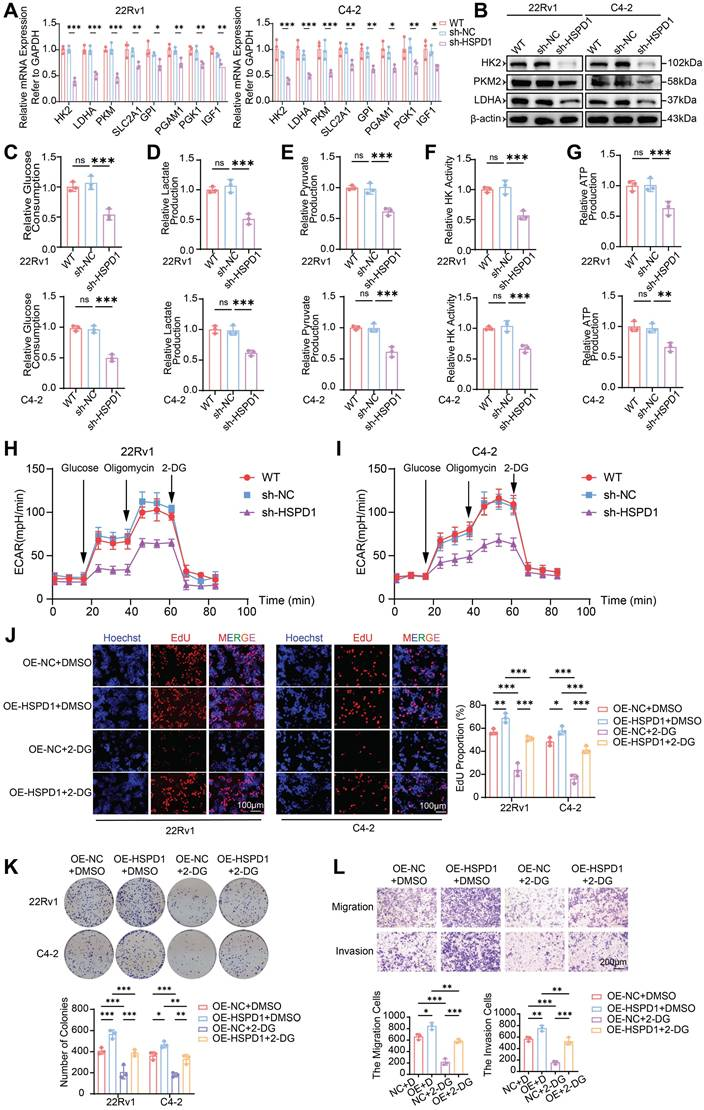
基于代谢组学和转录组学联合分析,本研究进一步筛选HSPD1基因敲减后激活的关键通路及其下游调控分子,发现糖酵解通路被显著抑制,且p53信号通路被激活,从而将HSP60、p53与糖酵解重编程联系起来。
综合多组学分析表明,HSPD1 能促进前列腺癌的糖酵解过程
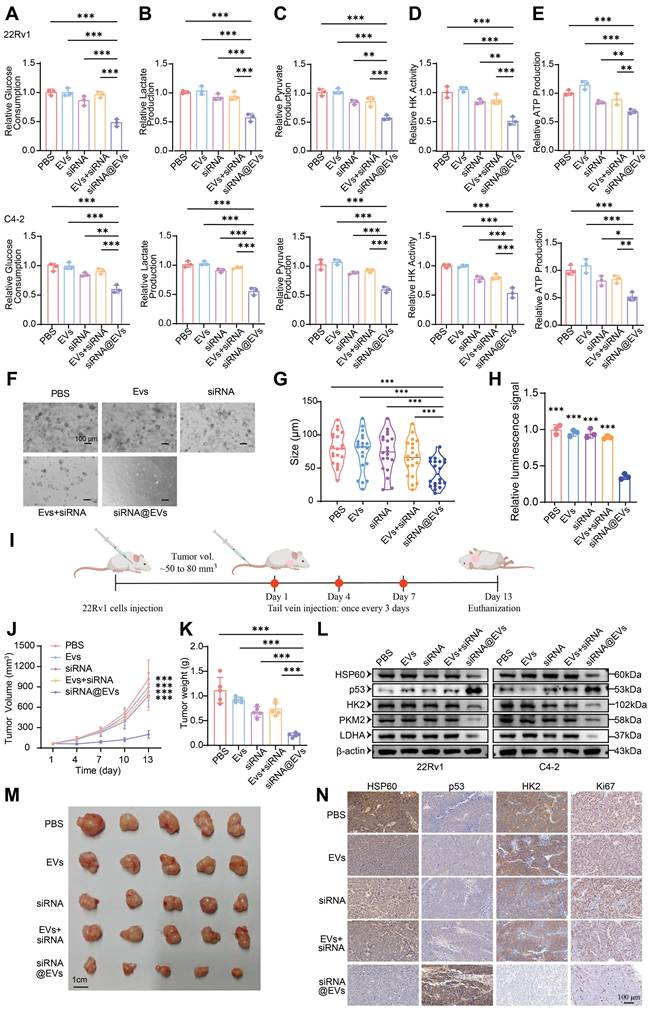
运用葡萄糖消耗量检测、乳酸含量测定、丙酮酸含量测定、己糖激酶活性测定和ATP含量测定等试验,验证HSPD1通过其下游分子p53在糖酵解中发挥的重要作用。
HSPD1通过增强糖酵解促进PCa细胞的恶性进展
递送系统创新与治疗潜力
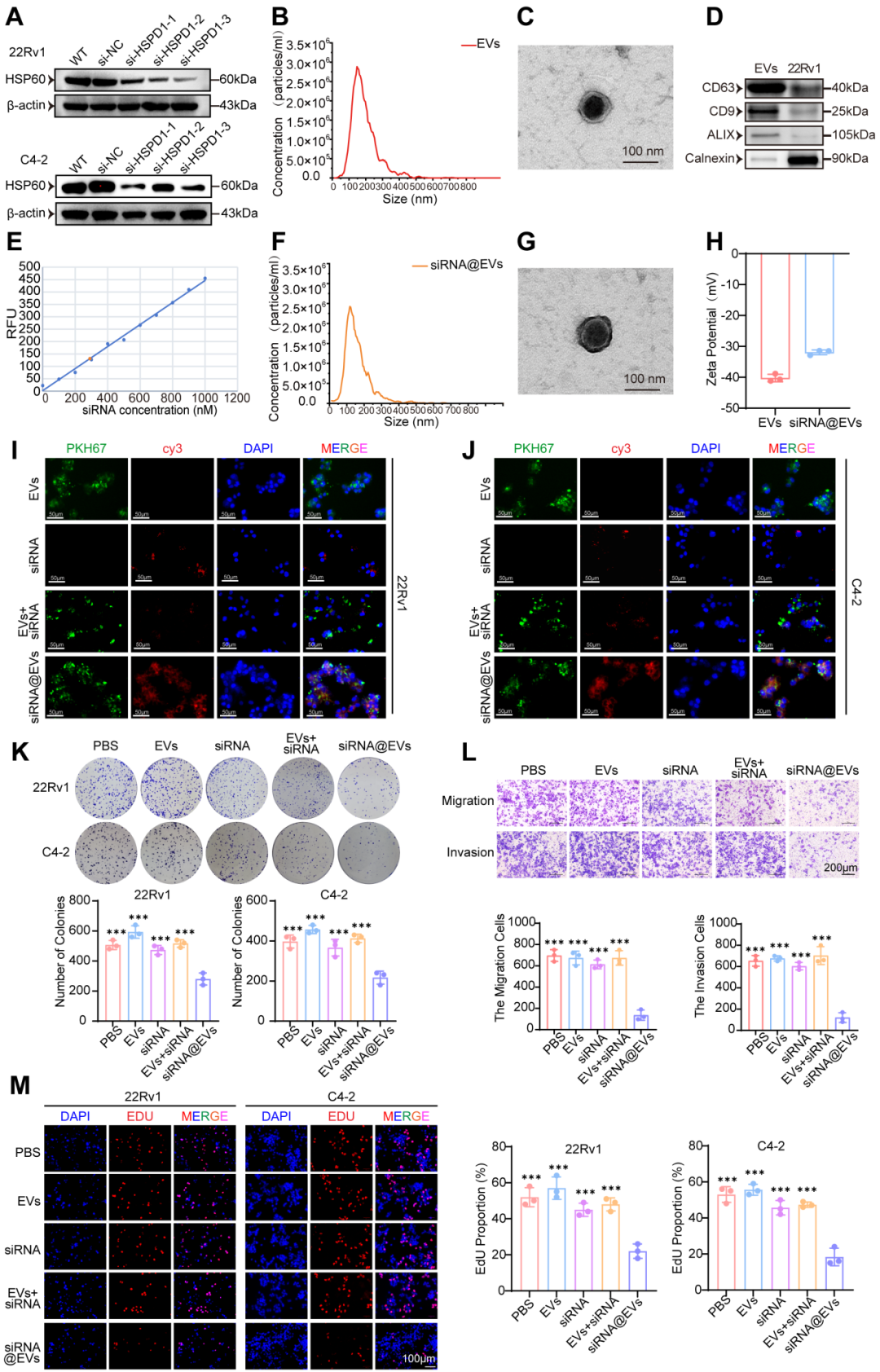
利用PCa细胞源EVs装载siRNA,构建siRNA@EVs递送系统。并采用透射电镜、粒径分析、Zeta电势检测及Western Blot进行囊泡特征鉴定。siRNA@EVs具有良好的肿瘤靶向性、高递送效率和生物安全性。
siRNA@EVs的构建、其基本特性的验证以及作用效果的评估
进一步通过CCK-8、EdU、克隆形成实验、Transwell迁移/侵袭实验及糖酵解表型测定等体外实验,评估siRNA@EVs对前列腺癌细胞增殖、转移及糖酵解能力的影响。在体外、患者来源类器官模型和裸鼠移植瘤模型中,siRNA@EVs能高效沉默 HSPD1,通过激活p53、抑制糖酵解,有效阻断PCa细胞增殖与转移,其显示出强效抑瘤作用且无显著系统性毒性。
siRNA@EVs通过p53介导的糖酵解重编程来抑制前列腺癌的增殖
总结与展望
该研究不仅揭示了HSP60/p53轴在前列腺癌代谢重编程中的核心作用,更成功开发了一种基于EVs的靶向递送系统,实现了基因沉默与代谢调控的双重治疗。这为克服前列腺癌(尤其是去势抵抗型)的治疗困境提供了新的思路,标志着RNAi疗法与代谢干预相结合的精准治疗模式向前迈出重要一步。
吉满助力
本研究中所用的基因敲减和过表达慢病毒均由吉满生物(Genomeditech)提供。 了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288 原文引用 “Lentiviruses with knockdown and overexpression of HSPD1 gene were purchased from Genomeditech (Shanghai, China).” 文献原文 https://doi.org/10.7150/ijbs.120760. Xu MY, Ma S, Ma SY, Liu CQ, Sun JX, An Y, Xu JZ, Zhang SH, Zeng N, Zhong XY, Zhu XH, Wang SG, Xia QD. Targeting the HSP60/p53 Axis with Extracellular Vesicle-Delivered siRNA Reprograms Glycolysis in Prostate Cancer. International Journal of Biological Sciences. 2026, 22(02): 641-662. 来源:课题组供稿