研究背景
啮齿动物和人类的数据都表明,肝脏中的sn-1,2-二酰基甘油(sn-1,2-DAG)作为第二信使直接过度激活蛋白激酶C(PKCε),是导致肥胖相关脂质代谢紊乱的关键途径,可诱导肝胰岛素抵抗和2型糖尿病。在肝脏中DAG含量增加的物质中,sn-1,2-DAG是唯一能直接激活肝脏中PKCε的立体异构体。抑制sn-1,2-DAG-PKCε信号轴是治疗代谢性疾病的一种很有前途的策略。
文献来源
近日,中国药科大学天然药物活性组分与药效国家重点实验室李萍/杨华/郑祖国团队在Cell Metabolism发表题为“Discovery of a potent allosteric activator of DGKQ that ameliorates obesity-induced insulin resistance via the sn-1,2-DAG-PKCε signaling axis”的研究性论文,该研究利用高内涵筛选结合液质联用技术,筛选出中药活性成分白术内酯II(AT II)可降低肝脏sn-1,2-DAG水平,抑制PKCε活性,改善肥胖型胰岛素抵抗,并发现AT II的作用靶蛋白为DGKQ,深入的机制研究发现AT II别构激活DGKQ,且这一效应具有物种保守性。
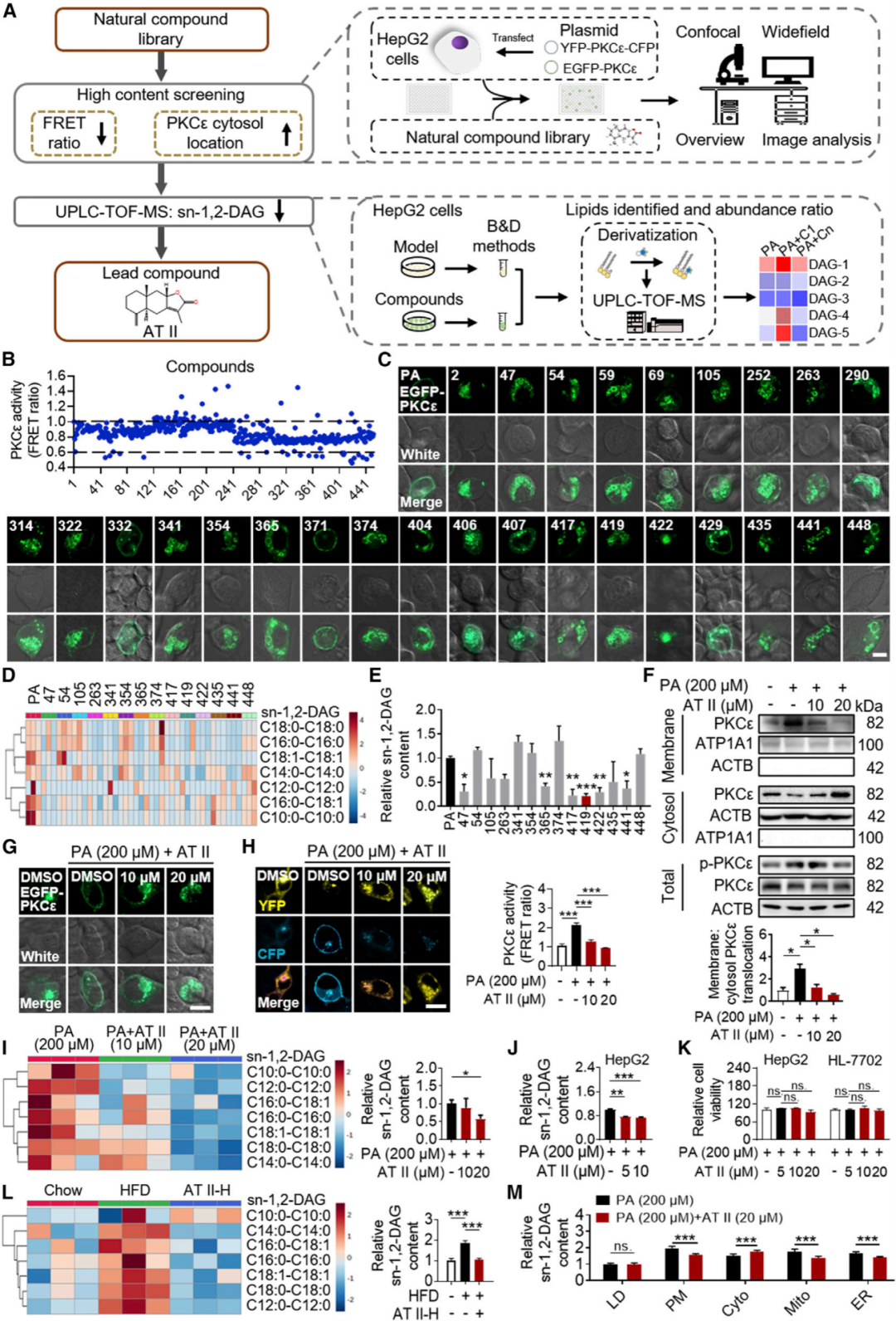
AT II作为一种新型的肝脏sn-1,2-DAG抑制剂,抑制PKCε活性
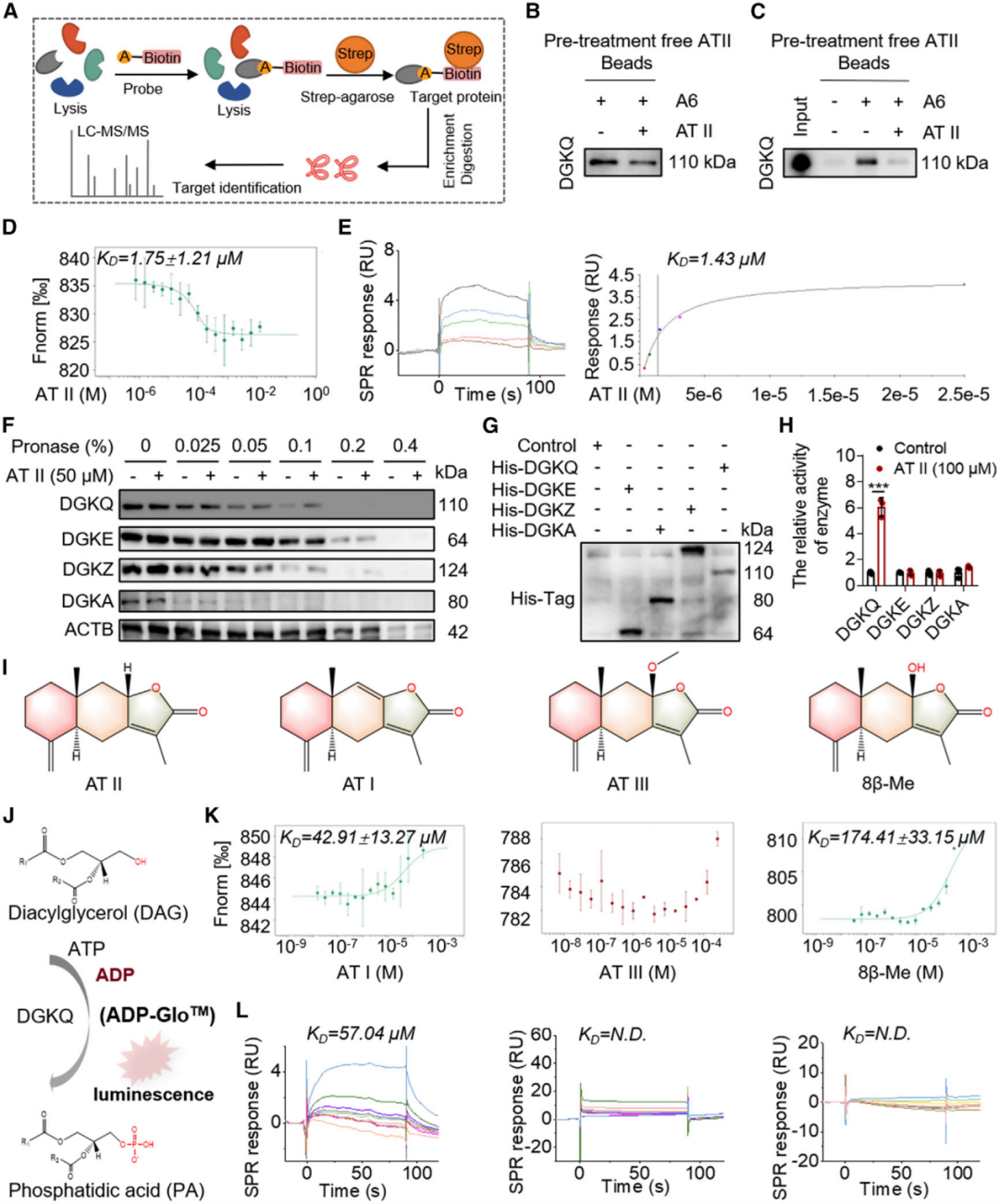
首先使用荧光共振能量转移(FRET)探针,分别在PKCε的N端和C端使用CFP和YFP来监测PKCε的活性。利用高内涵技术建立PKCε抑制剂的高通量筛选体系,同时利用UPLC-TOF-MS分析,建立了一种降低细胞sn-1,2-DAG的活性化合物的筛选方法。结果表明,AT II作为一种新型的肝脏sn-1,2-DAG抑制剂,抑制 PKCε活性。
(图1 AT II作为sn-1,2-DAG-PKCε通路抑制剂的筛选和鉴定)
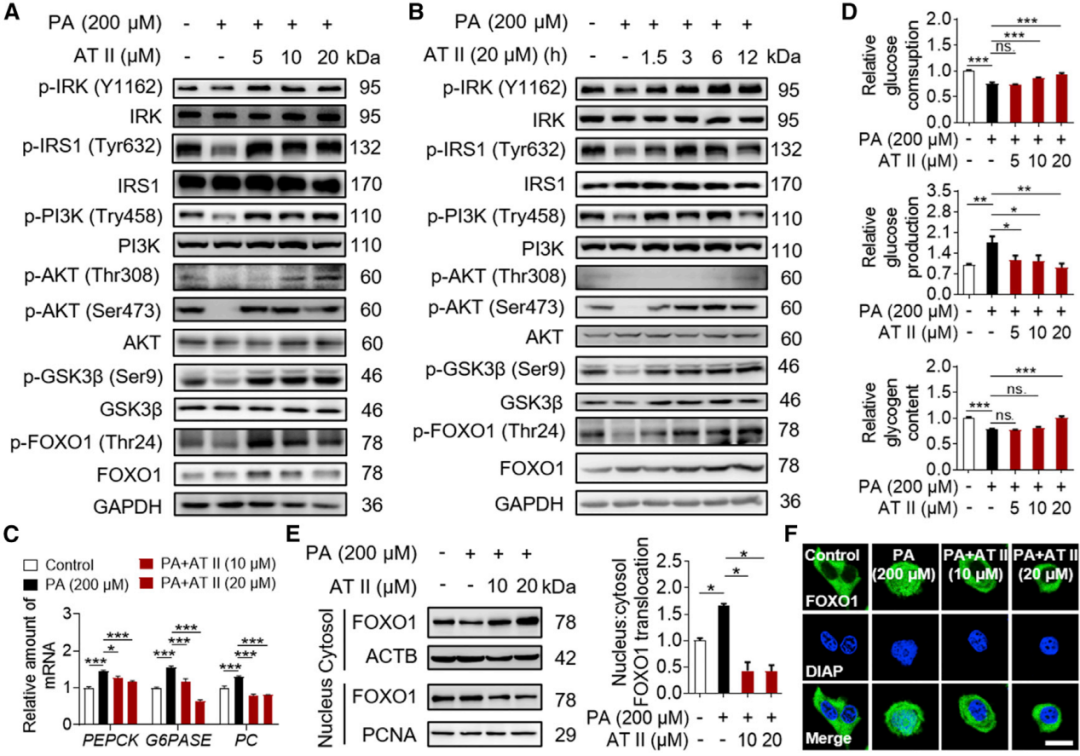
AT II通过胰岛素敏感的IRS1-PI3K-AKT通路抑制糖异生
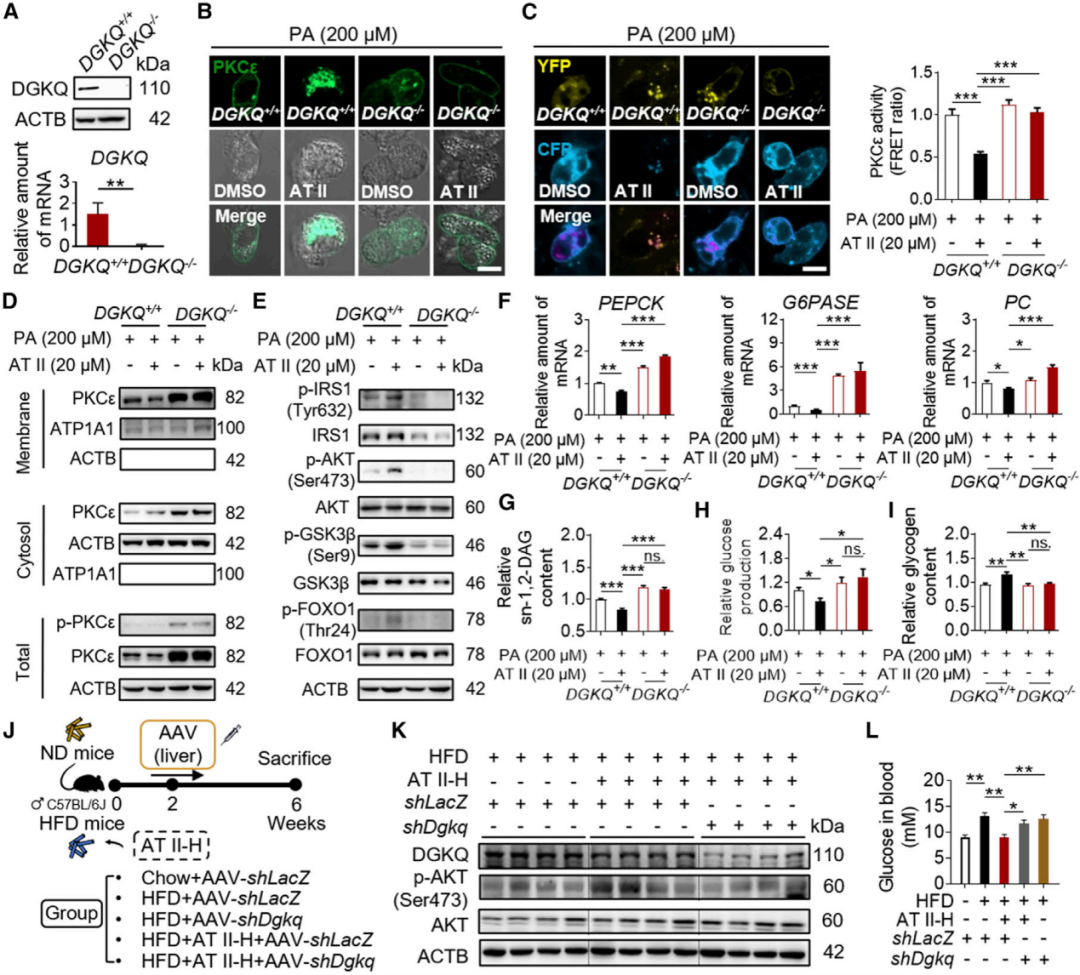
为了进一步确证AT II药效作用,首先在细胞水平考察了AT II改善胰岛素抵抗的效应,结果显示AT II以剂量和时间依赖性的方式上调PA介导磷酸化,降低了PA诱导的糖异生酶的基因表达和糖异生基因表达,即AT II通过胰岛素敏感的IRS1-PI3K-AKT通路抑制糖异生。
(图2 AT II通过抑制糖异生和促进肝糖原合成来改善DIO小鼠的胰岛素抵抗)
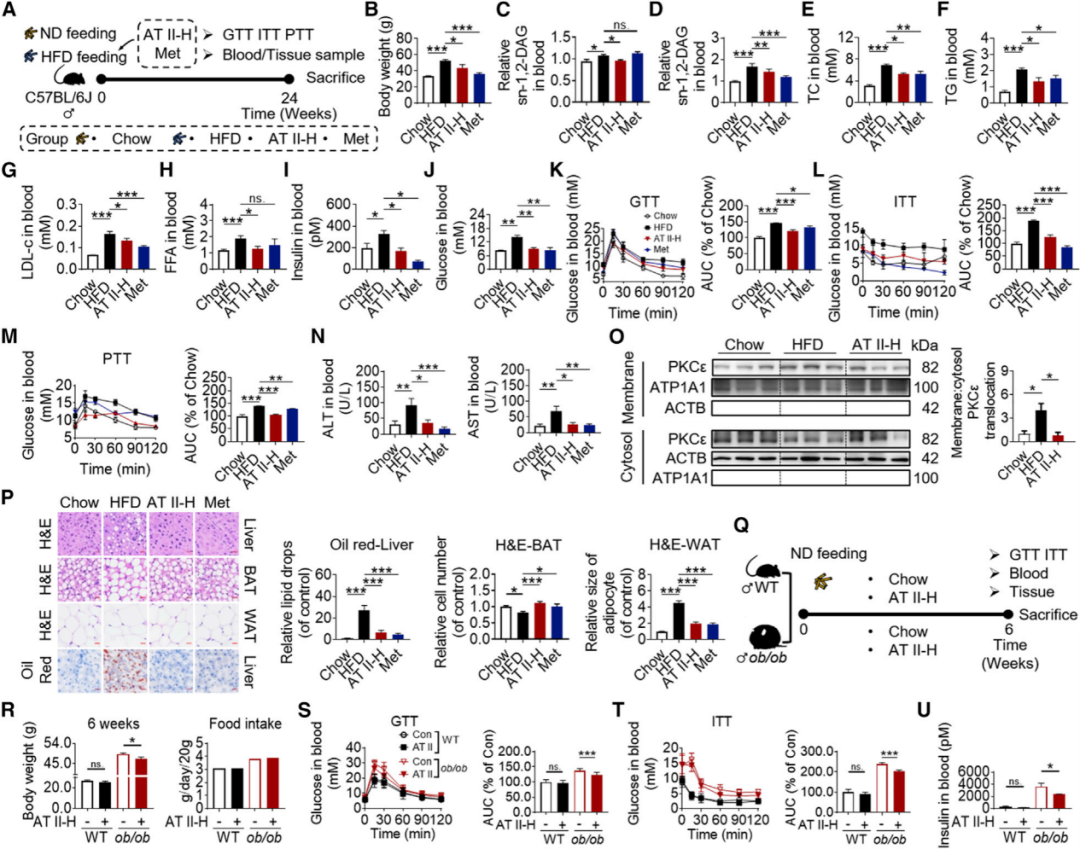
AT II改善肥胖诱导的高脂血症、肝脂肪变性和胰岛素抵抗
接着利用长期高脂饮食(24周)、短期高脂饮食(1, 2, 4, 6周)和ob/ob小鼠诱导肥胖胰岛素抵抗模型,分别研究AT II的药理效力,急性毒性试验显示,小鼠的行为和生命体征无明显变化。药代动力学结果表明AT II主要在肝脏中富集,而不产生毒性。为确定AT II的潜在疗效,分别给予二甲双胍治疗,同时进行高胰岛素-正血糖钳夹研究,结果发现AT II治疗导致小鼠的肝脏、肌肉和脂肪组织的全身胰岛素敏感性。与上述结果一致,AT II还降低了肝脏sn-1、2-DAG水平。为进一步研究AT II影响能量消耗和体重的机制,使用Ucp1基因敲除小鼠进行验证发现UCP-1的表达在脂肪组织中受到AMPK-PGC1a通路的调控,它可以促进脂肪组织的褐变,增加能量消耗。结果发现AT II通过脂肪组织中的AMPK-PGC1a-UCP-1信号轴促进能量消耗和降低体重。综上结果表明AT II改善肥胖诱导的高脂血症、肝脂肪变性和胰岛素抵抗。
(图3 AT II通过抑制糖异生和增加肝糖原合成,改善ob/ob或DIO小鼠的胰岛素抵抗和肝脂肪变性)
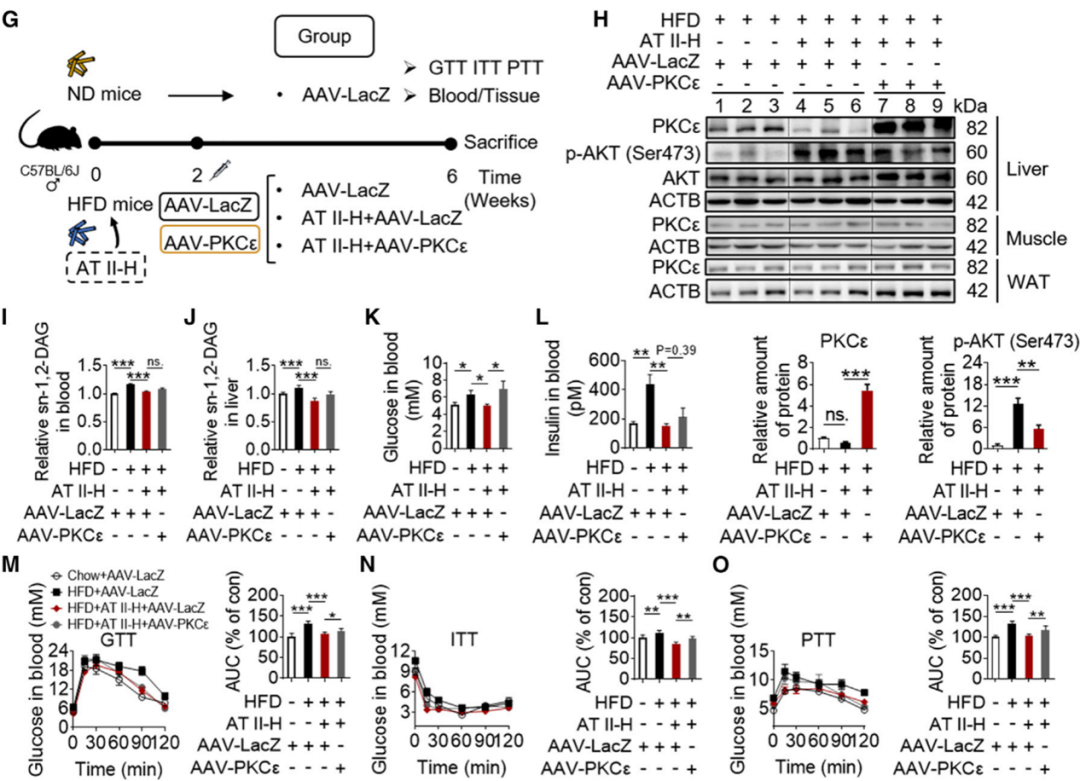
AT II改善肥胖型胰岛素抵抗是依赖于肝脏sn-1,2-DAG-PKCε信号轴
研究发现,在过表达PKCε的肝细胞中,AT II不再增加被PA损伤的胰岛素敏感 AKT通路的活性,同时使用腺相关病毒(AAV)介导小鼠肝脏过表达PKCε,逆转了AT II对AKT活性的影响。
综合以上多种基因操控和药理学手段,在细胞水平和动物水平均验证AT II改善肥胖型胰岛素抵抗是依赖于肝脏sn-1,2-DAG-PKCε信号轴。
(图4 外源性过表达PKCε逆转了AT II对AT II治疗后胰岛素抵抗的影响)
AT II并不影响 DGKA、DGKE或DGKZ的活性,且AT II的三种衍生物对DGKQ没有产生任何激活作用
为了确定AT II的潜在靶点并进一步阐明抗代谢疾病作用的分子机制,设计并合成了保留AT II原活性的探针(A6)。为了探究AT II是否直接影响DGKQ的激活,文中建立了一种定量和非放射性的方法来测量DGKs的活性,发现AT II并不影响 DGKA、DGKE或DGKZ的活性,且AT II的三种衍生物对DGKQ没有产生任何激活作用。
(图5 DGKQ被确定为AT II的靶点)
AT II改善肥胖型胰岛素抵抗完全依赖于肝脏DGKQ
因此,利用化学蛋白质组学、MST、SPR、CETSA、DARTs、非放射性酶活检测等方法,确定AT II可特异性激活二酰甘油激酶θ(DGKQ)。进一步通过DGKQ抑制剂R59022以及DGKQ KO细胞,在细胞水平上证明了AT II通过激活DGKQ,从而抑制sn-1,2-DAG-PKCε信号轴,发挥改善胰岛素抵抗作用;通过建立肝脏特异性Dgkq敲降小鼠,在动物水平验证了AT II改善肥胖型胰岛素抵抗完全依赖于肝脏DGKQ。
(图6 AT II通过sn-1,2-DAG-PKCε通路对胰岛素抵抗的影响依赖于DGKQ)
AT II和肝脏Dgkq之间的直接相互作用介导了AT II的体内药理活性
最后为了深入探究AT II激活DGKQ的作用机制,研究构建了DGKQ不同结构域的重组蛋白,通过A6探针进行pull down实验,发现AT II可与DGKQ的CRD和PH结构域结合。通过同源建模、位点突变等,发现CRD结构域中的S193、C204和S241三个氨基酸位点在AT II和DGKQ的结合中起着决定性作用,而PH结构域中的A496、P497和H498三个氨基酸则可能是有助于AT II进入药物结合口袋。为了进一步探索Dgkq这种新型药物口袋在AT II体内疗效中的重要性,作者通过AAV介导表达Dgkq野生型或Mut6突变体,恢复了肝脏中的Dgkq水平。其结果共同支持了AT II和肝脏Dgkq之间的直接相互作用介导了AT II的体内药理活性的假说。
(图7 CRD结构域的氨基酸以及PH结构域氨基酸对AT II的结合和作用具有重要作用)
综上所述,抑制sn-1,2- DAG-PKCε信号轴是治疗代谢性疾病的一种很有前途的策略,该研究中AT II激活DGKQ,改善与肥胖相关的胰岛素抵抗、脂质积累和能量消耗,是一种很有前途的改善肥胖诱导的胰岛素抵抗的先导化合物,其研究发现为肥胖型胰岛素抵抗的药物研发策略提供了借鉴。
吉满助力
本研究中所用相关腺相关病毒p-AAV-TBG-mPKCε-3Flag,p-AAV-TBG-GFP-MCS-3Flag,AAV8-GFP-U6-mDgk-shRNA,AAV8-GFP-U6-scrambledshRNA均由吉满生物提供。 了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288