文献来源
2023年3月29日,上海交通大学医学院附属第九人民医院和上海精准医学研究院王长谦教授、张家毓教授和顾俊教授团队在Advanced Science上发表了“The Imbalance of p53–Park7 Signaling Axis Induces Iron Homeostasis Dysfunction in Doxorubicin-Challenged Cardiomyocytes”的研究论文。
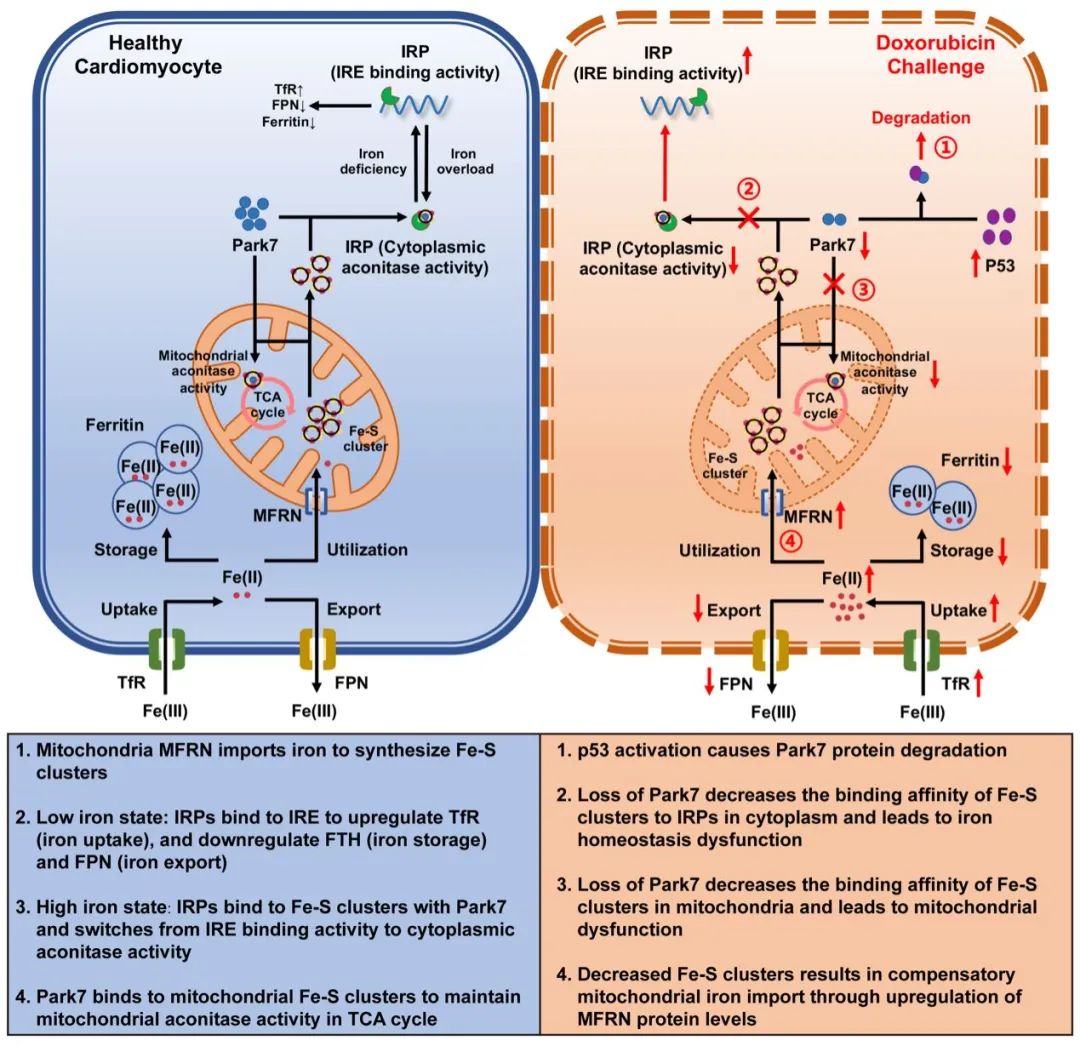
该工作中团队发现p53-Park7信号轴的紊乱在阿霉素诱导的心肌细胞铁稳态失衡中起着重要作用,心肌细胞特异性p53敲除或Park7过表达都能通过维持胞质和线粒体Fe-S簇结合活性而改善铁稳态,进而抑制心肌细胞铁死亡。这项研究对阿霉素心肌病的发病机制和防治提了一个新的观点,并为心肌细胞铁超载的溯源和铁死亡的预防提供了新的思路。
研究背景
以阿霉素为代表的蒽环类药物是一类广泛应用于治疗乳腺癌等各种实体肿瘤和血液系统恶性肿瘤的细胞毒性药物,是各种化疗方案的基石。然而,阿霉素引起的心脏毒性是限制其广泛应用的主要原因。阿霉素化疗期间临床心力衰竭的发生率呈剂量依赖性升高,当累积剂量上升到700mg/m2时,心衰发生率达到48%。因此,尽快明确其的发病机制,寻找早期检测指标和有效的干预靶点,是肿瘤心脏病学领域迫在眉睫的难题。
铁死亡是2012年发现的一种新的细胞死亡方式,其被证明在阿霉素心肌损伤中发挥着重要的作用。维持细胞正常的铁稳态在抑制细胞铁死亡中起到主导性作用,而阿霉素诱导的心肌细胞中,细胞铁稳态失衡的机制尚不明确,有待进一步探索。
项目研究
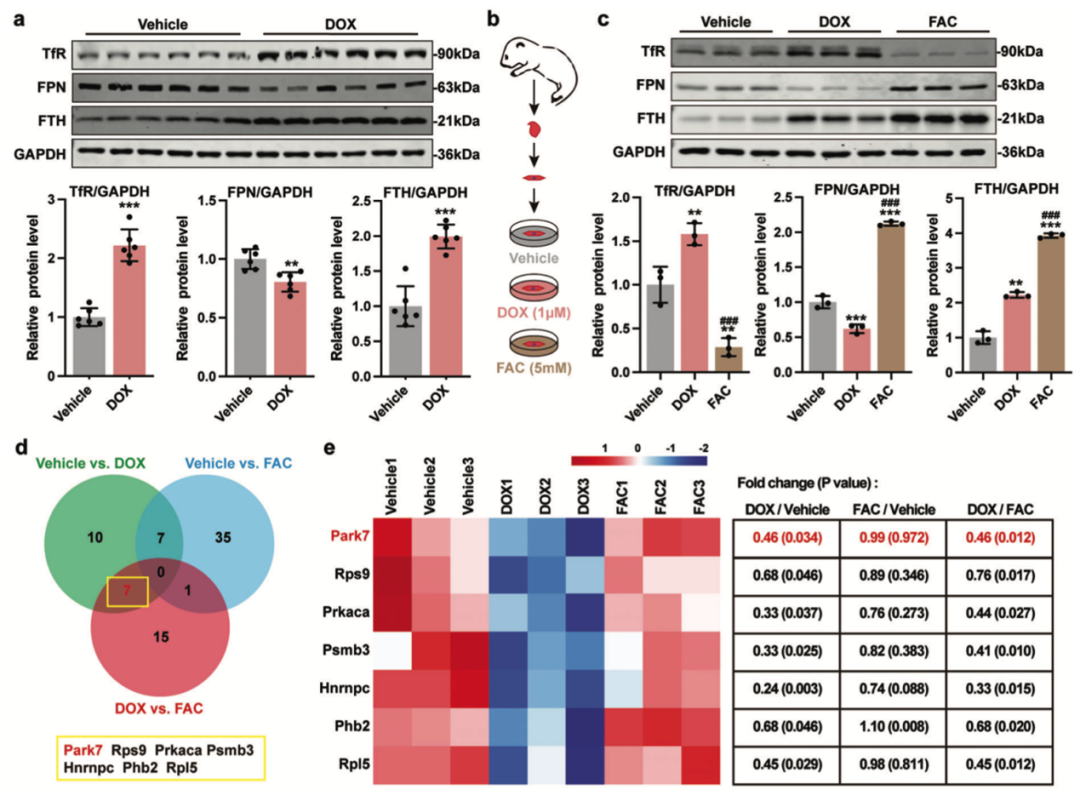
在该项目研究中,团队首先构建了慢性阿霉素心肌损伤模型,在体内外验证了阻断铁死亡能够显著改善阿霉素诱导的心肌细胞功能失调。随后,在体外实验中,通过对比FAC诱导的继发性铁超载模型,发现阿霉素刺激的心肌细胞失去了代偿心肌细胞铁稳态的能力,表现为Fe-S簇结合活性下降,铁稳态相关蛋白表达失调及胞浆和线粒体铁超载。
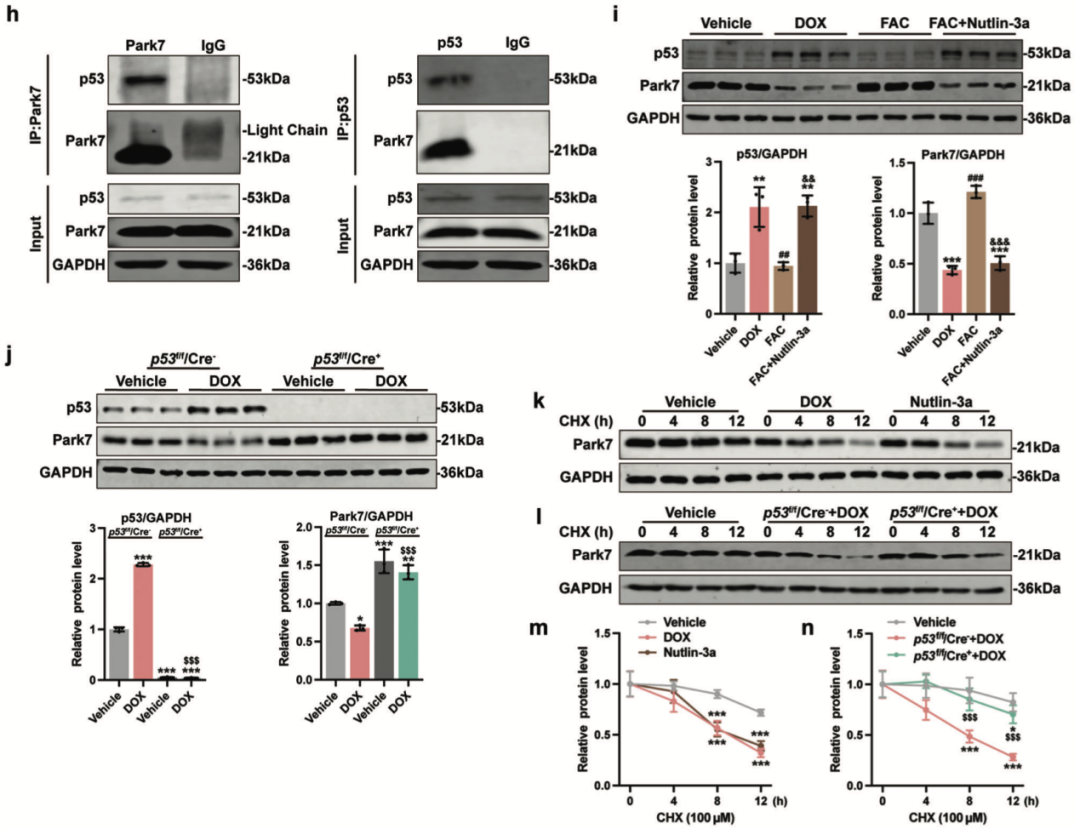
进一步地,通过蛋白组学分析寻找阿霉素刺激诱导心肌细胞铁稳态失衡的关键因子,发现心肌细胞Park7在调控细胞铁稳态中发挥重要作用,Park7一方面通过维持胞浆Fe-S簇结合活性,以IRP-IRE系统调控心肌细胞铁稳态,另一方面通过维持线粒体Fe-S簇结合活性,调控线粒体铁稳态和线粒体功能。而阿霉素通过激活p53促进心肌细胞Park7泛素化水平,进而促进Park7的降解,导致心肌细胞铁稳态失衡。
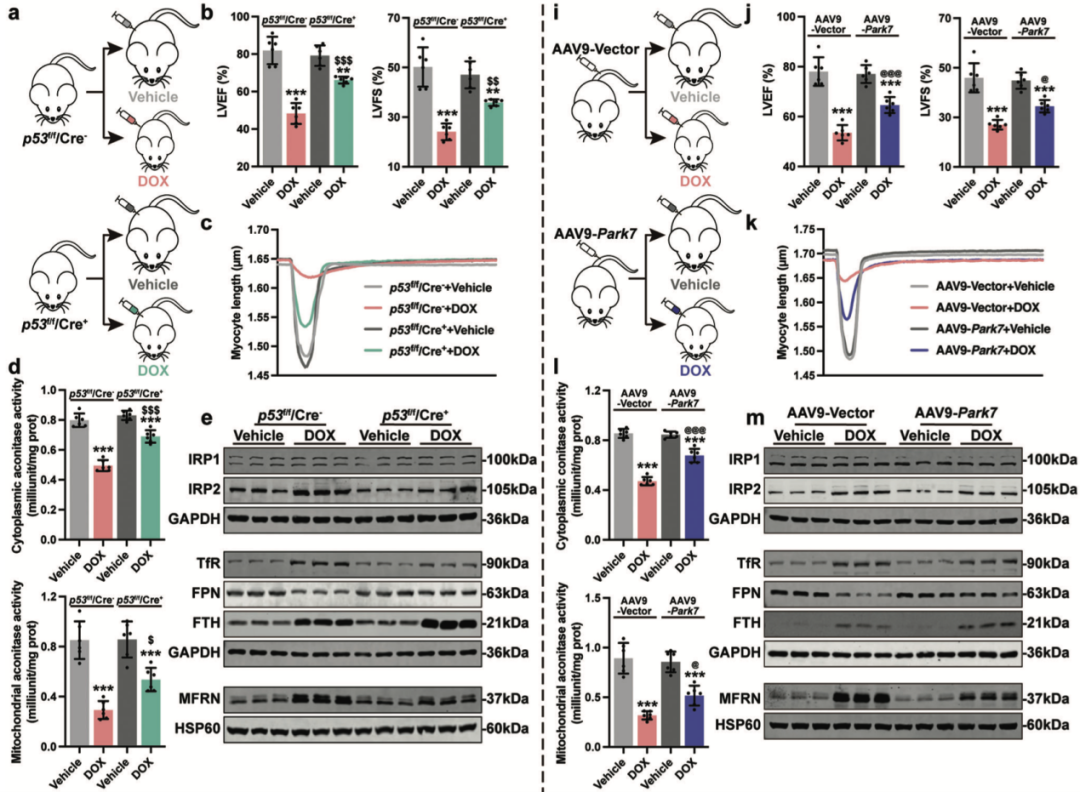
最后,团队通过构建p53心肌细胞特异性敲除小鼠和Park7心肌细胞特异性过表达小鼠,建立慢性DoIC模型,在体内进一步验证了靶向p53-Park7信号轴在维持心肌细胞铁稳态和抑制阿霉素诱导的心肌损伤中的作用。
该研究由上海交通大学医学院附属第九人民医院心内科及上海精准医学院王长谦教授、张家毓教授和顾俊教授团队合作完成。第九人民医院心内科潘建安博士、精准医学院熊蔚瑶博士为共同第一作者。王长谦教授、张家毓教授和顾俊教授为共同通讯作者。该工作得到国家自然科学基金、上海市科委自然科学基金、上海浦江人才计划等项目资助。
吉满助力
本研究中所用心肌特异性启动子cTNT表达的Park7 cDNA(AAV9-Park7), AAV9-Vector, Park7过表达(Lenti-Park7)和干扰慢病毒(Lenti-shPark7)均由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288