研究背景
近年来,免疫治疗在肿瘤治疗方面取得了很大进展,但由于肿瘤的非免疫原性和强大的免疫抑制环境的限制,再加上传统药物对大脑的渗透有限,三阴性乳腺癌症脑转移患者很难从免疫治疗中获益。
文献来源
2月,复旦大学药学院蒋晨团队在《Bioactive Materials》期刊发表文章:Nanomaterials with dual immunomodulatory functions for synergistic therapy of breast cancer brain metastases,研究人员提出了一种类似鸡尾酒式的微环境调节化疗免疫协同致敏治疗策略,并构建了还原敏感的免疫微环境调节纳米材料SIL@T,用靶向肽修饰后可穿透血脑屏障BBB,随后内化到转移性乳腺癌症细胞中,在细胞中反应性地释放水飞蓟宾(SIL)和奥沙利铂(OXA)。并且SIL@T会优先在转移部位积聚,可显著延长模型动物的生存期。机制上,研究表明SIL@T可有效诱导转移细胞的免疫原性细胞死亡,激活免疫反应,增加CD8+T细胞的浸润。同时,转移灶中STAT3的激活减弱,导致免疫抑制微环境逆转。
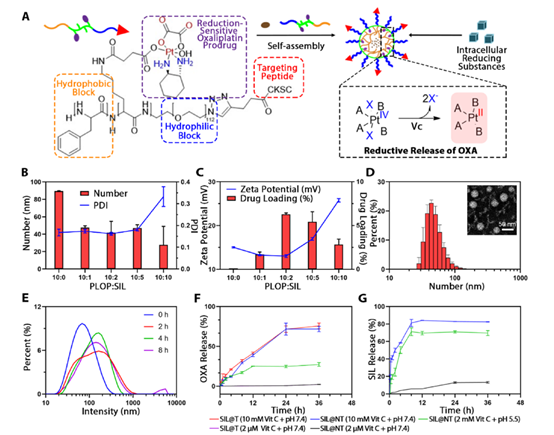
合成纳米材料SIL@T
在本研究中,研究人员设计并合成了负载化疗药物的还原敏感聚合物CSKC-PEG-pLys/OXA-pPhe(CPLOP),作为封装逆转免疫抑制微环境调节因子SIL和用于增加TIL浸润OXA的纳米载体以及包封胶束,可以满足在肿瘤细胞中高度还原环境时实现对转移性肿瘤的选择性杀伤,并且具备有效地穿透BBB能力。
(Fig.1 Sil@T的设计、配方优化、表征和释放动力学示意图)
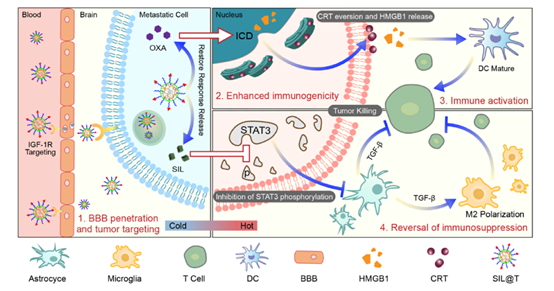
SIL@T的体外治疗作用
在体外实验中,当SIL@T内化到转移性乳腺癌症细胞中后,胶束结构被破坏,包封的SIL被泄漏以抑制STAT3磷酸化,OXA被释放能够在杀死肿瘤的同时促进肿瘤细胞释放HMGB1从而增强免疫反应的激活。
(Fig.2具有双重免疫调节功能的sIL@T治疗乳腺癌脑转移的示意图)
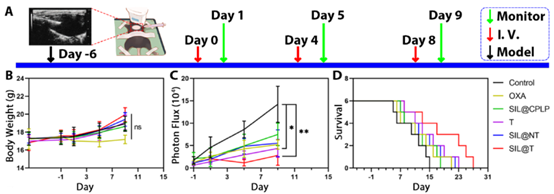
SIL@T对BM-小鼠的治疗作用
为进一步证实SIL@T的抑瘤作用,研究人员构建了4T1-BR脑转移瘤小鼠模型,在BM小鼠建立后第7天开始给药并不断监测BM小鼠的体重,脑转移信号以及BM小鼠的存活情况,结果显示与对照组相比,SIL@T治疗组在模型小鼠中显示出对转移瘤生长的抑制和中位生存期的延长且均未见明显脏器损伤,表明SIL@T具有较好的抑瘤作用并且无明显毒性。
(Fig.3 不同制剂给药后小鼠体重,转移瘤信号以及BM小鼠存活变化曲线示意图)
综上所述,研究人员开发了一种具有双重免疫调节功能的纳米材料,通过主动靶向和响应性释放的策略,将OXA和SIL精确地输送到脑转移瘤的肿瘤细胞中,用于治疗脑转移瘤,还原敏感型OXA前药可精确杀伤肿瘤细胞并诱导免疫激活,SIL可逆转免疫抑制微环境,通过适应性免疫增强对转移性肿瘤的选择性杀伤。同时,SIL@T可增加效应T细胞的浸润,减少TAM的M2极化和Treg细胞在转移灶内的浸润,从而达到抑制肿瘤转移,延长荷瘤模型小鼠的中位生存期的目的。
吉满生物
本实验所用Luc标记的4T1-BR细胞株由吉满生物(Genomeditech)构建。 如想了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288