研究背景
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统常见的恶性肿瘤,约占肾癌的90%。肾透明细胞癌 (ccRCC)是RCC的主要病理亚型,约占RCC的 70%。ccRCC起病隐匿,早期缺乏特异性临床症状,易被误诊。目前,ccRCC的治疗主要以手术结合靶向药物为主。然而,早期诊断的困难、靶向药物的耐受性和患者生存率的巨大波动是对抗ccRCC的挑战. 因此,研究ccRCC的发病机制,探索针对ccRCC患者的新治疗方法,成为当前肿瘤研究的热点。
文献来源
近日,华中科技大学同济医学院附属协和医院泌尿外科章小平课题组等人在Cancer Communications发表研究性论文“N6-methyladenosine-modified DBT alleviates lipid accumulation and inhibits tumor progression in clear cell renal cell carcinoma through the ANXA2/YAP axis-regulated Hippo pathway”,研究发现,DBT被证实是具有显着预后预测价值的Hippo相关标志物,其下调是由ccRCC 中的甲基转移酶样3(METTL3)介导的N6-甲基腺苷 (m6A)修饰引起的。功能研究表明DBT作为一种肿瘤抑制因子,可抑制肿瘤进展和纠正ccRCC中的脂质代谢紊乱。机制研究上膜联蛋白A2(ANXA2)与DBT的硫辛酰结合域相互作用,激活Hippo信号,导致 yes1相关转录调节因子(YAP)的核定位降低和脂肪生成基因的转录抑制。
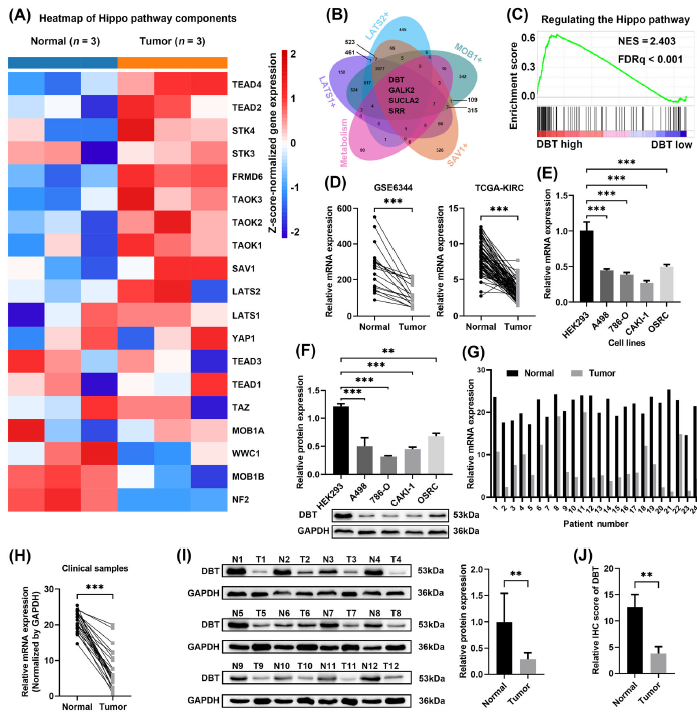
DBT在ccRCC中下调提示预后不良
首先,通过高通量测序数据显示ccRCC与邻近组织相比,Hippo通路中相关基因表达具有差异,进一步筛选结合临床数据分析,发现DBT在ccRCC中下调,是ccRCC不良预后的预测因子。
(Fig.1 DBT在ccRCC中下调提示预后不良)
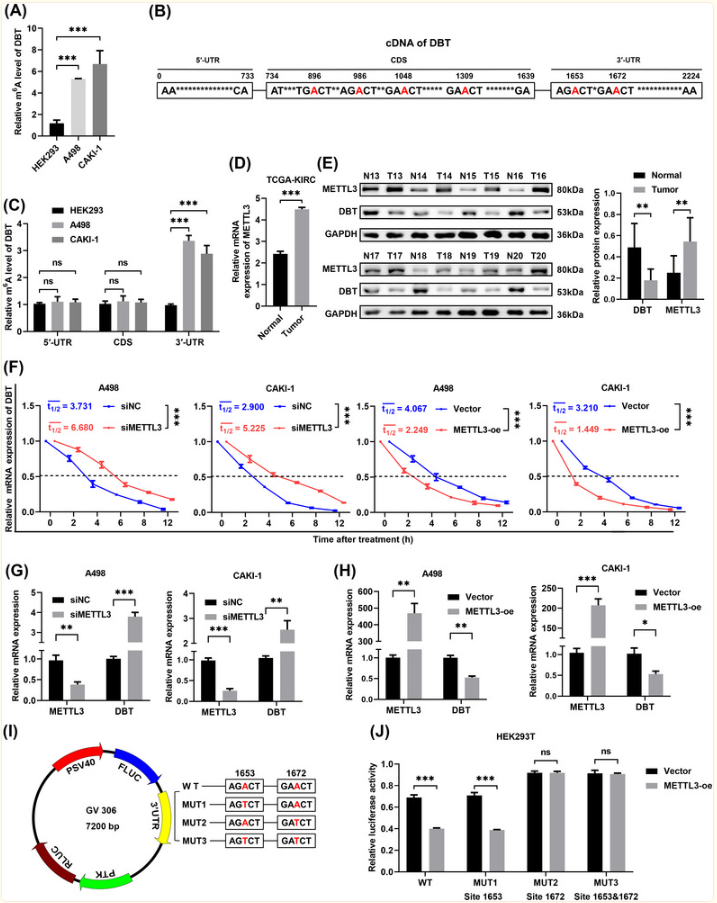
METTL3通过DBT的3‘UTR中的1672位点介导的m6A甲基化降低ccRCC中DBT的表达
其次,假设DBT的mRNA被m6A调控因子修饰,如甲基转移酶复合物。MeRIP-qPCR检测结果显示,m6A修饰的DBT在A498和CAKI-1细胞中的富集程度高于HEK293细胞。结合生信预测和双荧光素酶检测研究DBT与METTL3的互作,证明了METTL3通过DBT的3‘UTR中的1672 位点介导的m6A甲基化降低ccRCC中DBT的表达。
(Fig.2 METTL3介导的m6A修饰参与DBT下调)
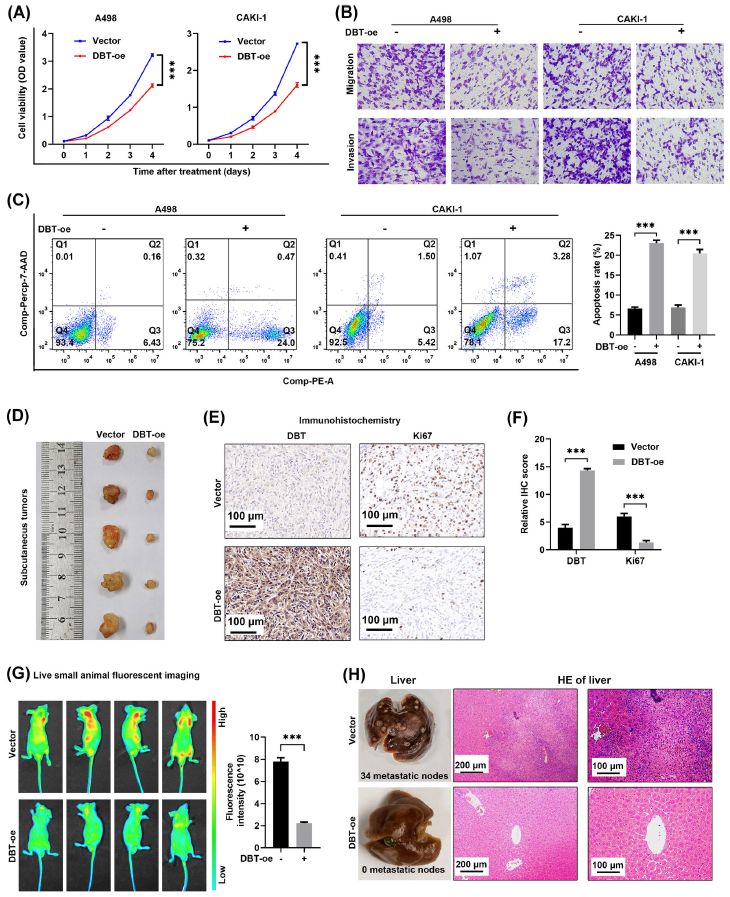
DBT在ccRCC中发挥抑癌作用
体内外功能研究中,过表达DBT会抑制ccRCC的增殖,迁移和侵袭能力,并显著抑制了肿瘤的转移,减少了肝脏中转移淋巴结的数量,表明DBT在ccRCC 中发挥抑癌作用;
(Fig.3 DBT在体外和体内抑制了ccRCC的进展)
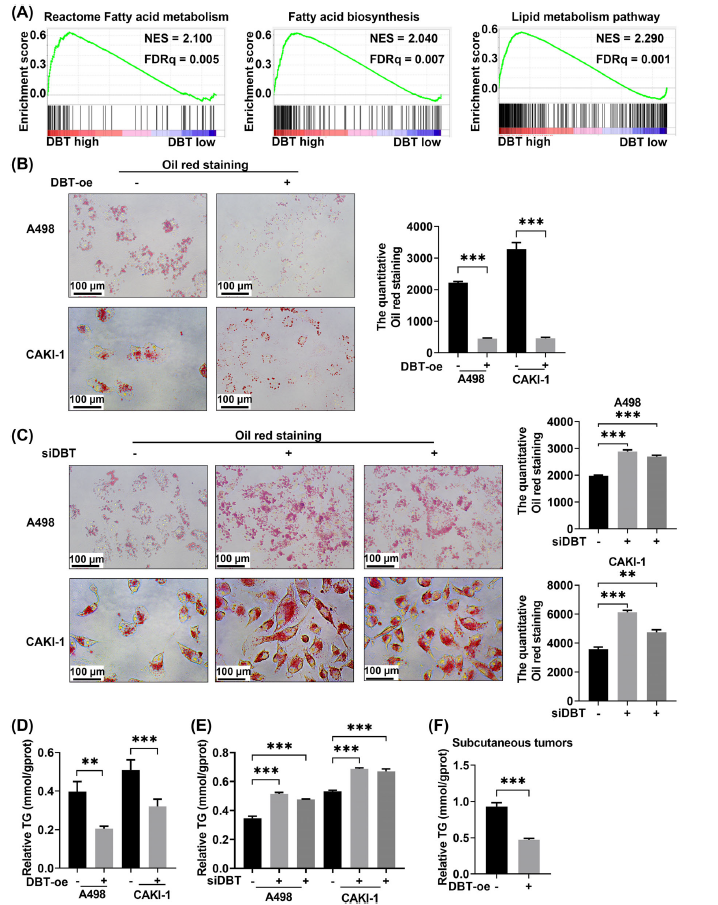
DBT是ccRCC脂质积累的调节因子
由于ccRCC最突出的生物学特征是细胞内脂滴积累,因此本研究通过敲低DBT和过表达DBT研究对脂质代谢的调控,研究发现过表达DBT后细胞中脂质积累减少,敲低DBT则相反。在油红染色和脂质相关基因检测结果与此一致,以上证明DBT是ccRCC脂质积累的调节因子。
(Fig.4 DBT 减少了ccRCC中的脂质积累)
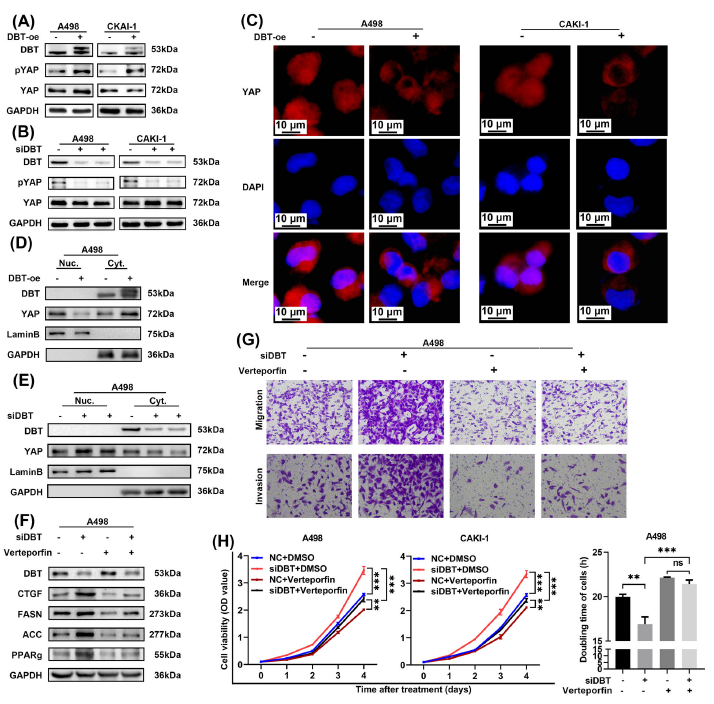
Fig.5 DBT激活Hippo信号以抑制YAP的转录活性
DBT对ccRCC中Hippo通路是否有影响,作者检测了 Hippo通路核心组分的RNA水平,结果表明DBT过表达细胞中磷酸化的YAP有所增加,并抑制了YAP的核定位,脂质通路相关基因的表达降低。敲低细胞模型与之相反。证实DBT激活了Hippo通路,进而抑制了ccRCC中的脂质积累和肿瘤进展。
(Fig.5 DBT激活Hippo信号以抑制YAP的转录活性)
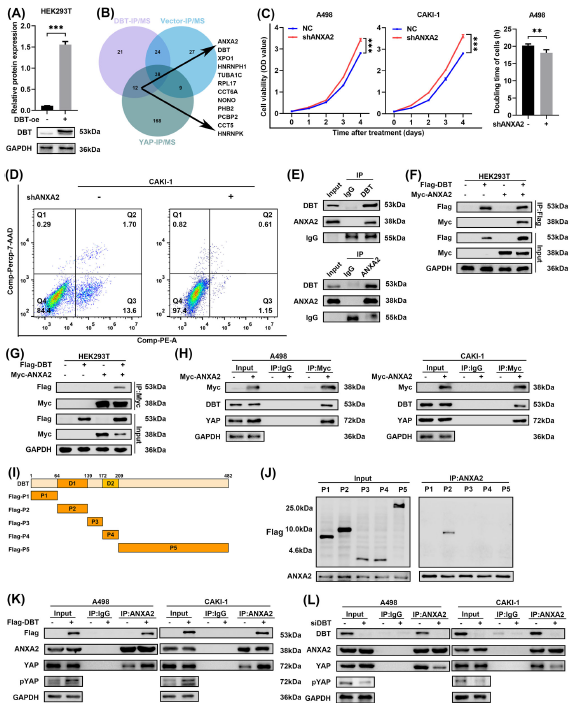
DBT通过与ANXA2发生直接相互作用,调节Hippo通路并抑制癌症进展和脂质积累
为了进一步确定DBT如何调节Hippo信号,通过数据库分析及免疫沉淀实验,发现DBT通过与ANXA2发生直接相互作用,调节Hippo通路并抑制癌症进展和脂质积累;
(Fig.6 DBT通过与ANXA2相互作用来调节Hippo信号)
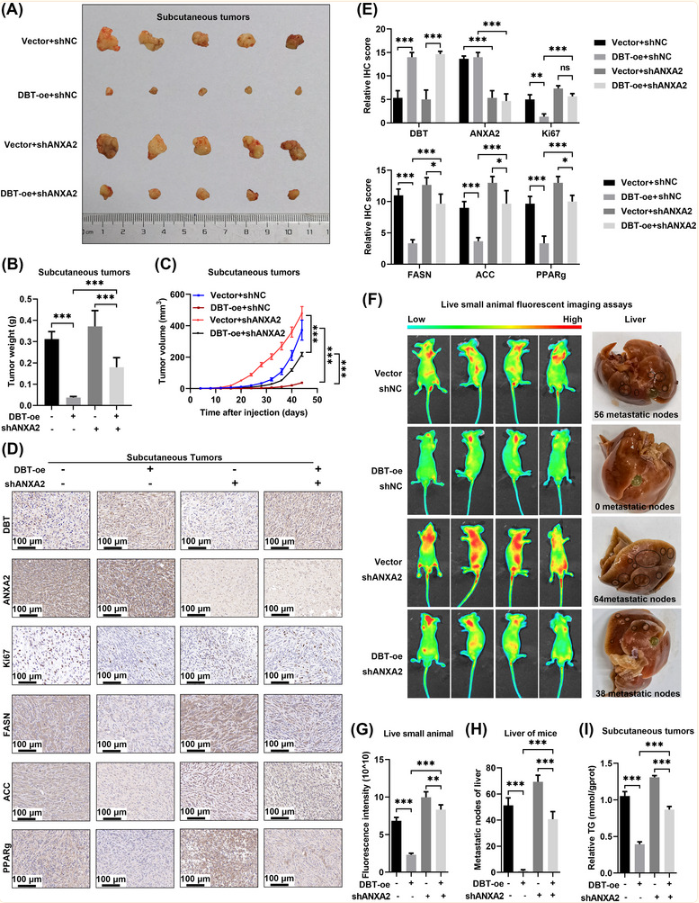
DBT-ANXA2-YAP轴在体内抑制肿瘤进展和脂质积累
最后通过皮下肿瘤模型和转移性肿瘤模型在体内研究了DBT-ANXA2-YAP轴的功能,DBT过表达产生了有效的肿瘤生长抑制,而ANXA2的敲低可以逆转由 DBT过表达引起的生长抑制,之后对脂质通路的相关基因进行验证,证实DBT-ANXA2-YAP轴抑制了肿瘤进展并抑制了ccRCC中的脂质积累。
(Fig.7 DBT-ANXA2-YAP轴在体内抑制肿瘤进展和脂质积累)
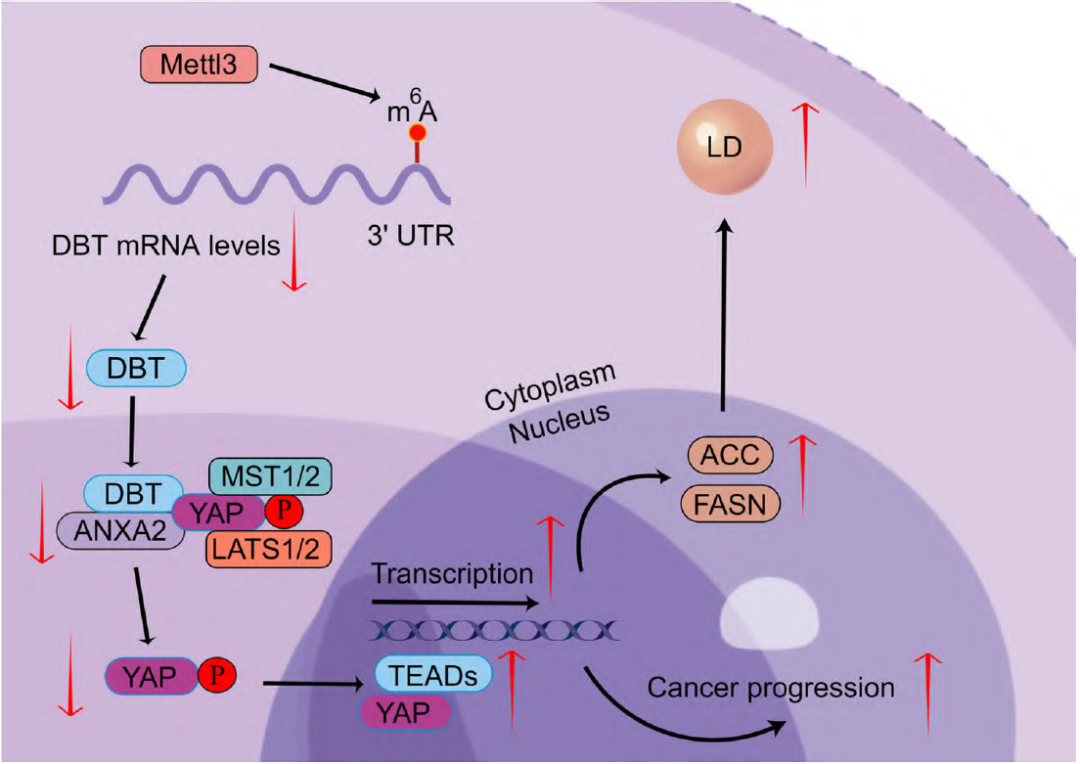
综上所述,该研究表明DBT通过与ANXA2相互作用来调节Hippo通路,ANXA2引导YAP被磷酸化抑制。由METTL3介导的m6A 修饰诱导的DBT异常下调通过增加YAP的核定位促进ccRCC的进展和脂质积累。因此,本研究揭示了调节ccRCC 中YAP活性和脂质代谢的重要调节机制,并为开发针对YAP或DBT m6A修饰的ccRCC治疗策略提供了理论指引。
(Fig.8 ccRCC中DBT的机制方案)
吉满助力
本实验所用METTL3和Myc-ANXA2过表达慢病毒均由吉满生物(Genomeditech)提供。 了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288