细胞-细胞融合是组织发育和修复以及疾病进展中的关键细胞事件。在癌症进展过程中,癌细胞易与其他细胞融合,如内皮细胞、上皮细胞和免疫细胞等,以形成恶性杂交细胞。由于杂交细胞具有两个亲本细胞的基因组,可能表现出新的特性,如增强的抗凋亡能力、免疫逃避能力、转移潜力、治疗耐药性和癌症干细胞特性。
研究背景
抑制癌细胞融合和降低融合细胞的恶性程度被认为是一种很有前途的癌症治疗策略。例如,抗生素二甲胺四环素和SB-3CT(一种MMP-9抑制剂)可损害TNF-α介导的乳腺上皮细胞和乳腺癌细胞之间的细胞融合。白细胞介素4受体(Interleukin 4 receptor, IL-4R)抗体可抑制肌祖细胞-横纹肌肉瘤融合,阻断肿瘤进展。XAV-939可通过抑制Wnt/β-catenin信号通路降低巨噬细胞/癌融合细胞的恶性。
尽管细胞融合在癌症的进展和转移中起着至关重要的作用。然而,有效调节细胞融合行为和及时评估细胞融合,为个性化治疗提供准确的信息始终面临着挑战。
研究成果
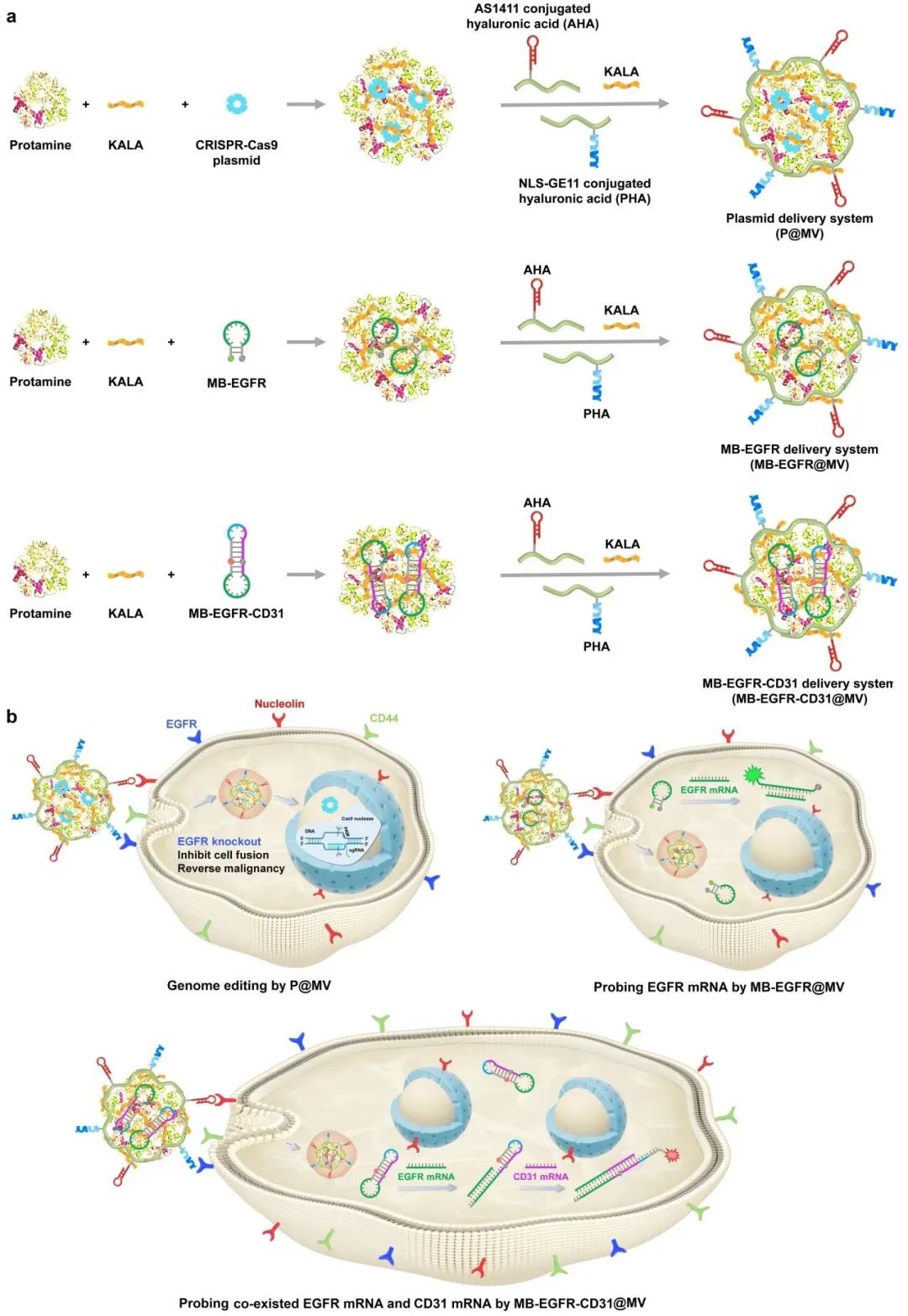
2023年8月,武汉大学程巳雪教授团队在Advanced Science(IF=15.1)发表了题为“A Multifunctional Delivery System for Remodulating Cell Behaviors of Circulating Malignant Cells to Prevent Cell Fusion”的文章,研究中针对上述困难构建了一个基于多功能传递载体的有效便捷的平台,从而实现基因组编辑质粒和基于分子信标的AND逻辑门的癌症靶向递送。
通过多功能传递载体递送的基因组编辑质粒敲除CMC中的EGFR可以有效地调节细胞融合行为,通过多功能传递载体递送的与逻辑门可以在单细胞分辨率下精确探测EGFR敲除对CMC融合抑制的影响。
基因编辑治疗和与逻辑门检测结果表明,EGFR被敲除后,编辑的CMC表现出显著的细胞融合抑制能力,而未编辑的CMC可以与人脐静脉内皮细胞(HUVEC)融合形成杂交细胞。由于利用几毫升血液对CMC进行体外研究的方便性,这一研究方法可以对特定治疗进行频繁评估,为动态调整和优化抗癌治疗提供有价值的指导,为个体化精准治疗提供了新的有效平台。
图1 质粒和分子信标传递系统用于调节恶性细胞行为并检测标靶mRNA
该研究创新点在于设计了由AS1411偶联的透明质酸和NLS-GE11肽偶联的透明质酸修饰的多功能递送载体,以特异性靶向癌症患者的循环恶性细胞(CMC),递送用于表皮生长因子受体(EGFR)敲除的基因编辑质粒(Genomeditech,Shanghai, China)和用于检测细胞融合的与逻辑门。EGFR敲除显著抑制了细胞融合能力,与逻辑门评估癌细胞融合为实现精准个性化治疗提供了可靠的工具。
吉满助力
本研究中针对EGFR基因的CRISPR-Cas9敲除质粒均由吉满生物提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
文章来源:课题组供稿
DOI:10.1002/advs.202303309
文献原文:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202303309
原文引用:
“CRISPR-Cas9 plasmids for EGFR knockout(EGFR Genbank accession:NM_0 013 468 98.2)were from Genomeditech (Shanghai, China). ”