文献来源
2023年7月3日,上海交通大学医学院附属第九人民医院曹巍教授团队和上海交通大学医学院赵旭赟研究员课题组合作在Advanced Science(IF=15.1)在线发表题为“Yin Yang 1-Induced Long Noncoding RNA DUXAP9 Drives the Progression of Oral Squamous Cell Carcinoma by Blocking CDK1-Mediated EZH2 Degradation”的研究论文。
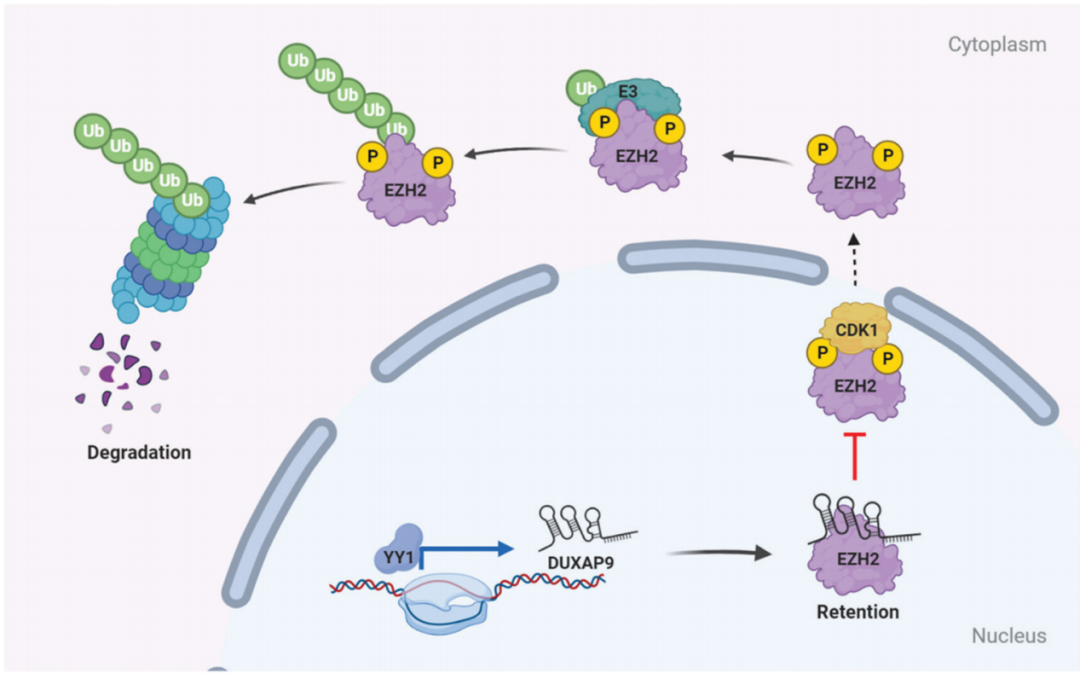
该研究报道了一种在口腔鳞癌异常高表达的lncRNA DUXAP9(DUXAP9)通过EZH2依赖性方式促进OSCC的增殖、迁移、侵袭、移植瘤生长和OSCC肺转移能力。机制上发现,转录因子YY1能激活 DUXAP9的表达,DUXAP9能与EZH2结合并抑制细胞周期依赖性激酶(CDK1)介导的EZH2磷酸化(Thr345/487)和泛素化,从而抑制EZH2核浆转运过程和EZH2蛋白降解。
研究背景
口腔鳞状细胞癌(OSCC)是头颈部最常见的恶性肿瘤之一,它是一种具有较强侵袭性和异质性肿瘤。虽然以手术切除辅以放疗、化疗和靶向治疗为口腔鳞癌治疗的标准治疗方式不断的完善和改进,晚期OSCC患者5年的总生存率仍然很低。究其原因主要是OSCC发病机制的复杂性和不确定性,缺乏可靠的诊疗靶点。
项目研究
Zeste同源物2(EZH2)是Polycomb抑制复合体2 (PRC2)的催化亚基,一种高度保守的组蛋白甲基转移酶,可以催化组蛋白H3(H3- k27)的赖氨酸-27三甲基化,该酶在很大程度上被认为是基因转录调控的抑制因子,与细胞分化、维持成体干细胞群体和肿瘤发展有关。
曹巍教授团队前期的研究发现,EZH2是口腔白斑细胞恶性转化的关键致癌驱动因子(Cancer Prev Res 2011)。研究还证实EZH2在头颈鳞癌标本和细胞系中的表达显著升高,其异常高表达与病理分化差、不良病理风险因素和较差的总生存率和无病生存率相关(Cancer 2012)。EZH2也被证实参与上消化道肿瘤的进展,并与非小细胞肺癌患者的不良预后密切相关(PLoS One 2012)。
长链非编码RNAs (lncRNAs)属于至少有200个核苷酸的非编码RNAs亚型,包括反义、基因间、内含子转录本和假基因。lncRNAs的转录、加工和代谢与蛋白质编码基因的调控不同。lncRNAs在细胞核和细胞质中都有定位,这些lncRNAs的特异性定位决定了它们在染色质修饰、与转录因子相互作用、mRNA加工、充当“分子海绵”、形成核糖核蛋白复合物等基因表达和生物学功能方面的调控机制。
曹巍教授团队前期研究发现lncRNA PTENP1表达降低可促进头颈鳞癌细胞的恶性表型,其表达降低与OSCC癌患者生存率低有关(Sci Rep 2017)。进一步发现三个lncRNA组成的分子谱型能准确的预测头颈鳞癌患者的临床预后(Oral Oncol 2017)。此外,还发现新的lncRNA RC3H2通过miR-101-3p-EZH2轴促进口腔鳞癌细胞的增殖和侵袭(Mol Ther Nucl Acids 2020)。上述研究结果表明lncRNA可以作为OSCC预测性生物标志物或治疗靶点。
为了寻找OSCC可靠的诊疗靶点,曹巍教授团队通过高通量芯片筛选,发现DUXAP9在口腔鳞癌组织中异常高表达,其异常高表达与病理分化差、临床晚期、淋巴结转移、总生存率和疾病特异性生存率差相关。转录因子YY1能够激活DUXAP9转录表达。体内外过表达或者沉默DUXAP9可显著调控OSCC细胞增殖、迁移、侵袭和裸鼠皮下成瘤能力及肺转移模型转移能力。分子机制上研究揭示,DUXAP9与EZH2存在直接物理相互作用,DUXAP9通过抑制CDK1介导的EZH2的磷酸化和泛素化,阻断EZH2从细胞核向细胞质的易位,从而抑制EZH2的降解。
综上所述,该研究揭示了lncRNA DUXAP9在翻译后水平增加EZH2表达的新机制,进而驱动OSCC的进展,提示DUXAP9是OSCC治疗的新的潜在靶点。
文章模式图(图源自Advanced Science)
上海交通大学医学院附属第九人民医院周文凯硕士、口腔八年制在读学生冯逸升和林承重主治医师为共同第一作者,通讯作者为曹巍教授和赵旭赟研究员。
该文章已收到杂志封面邀请。
吉满助力
本研究中所用长非编码RNA DUXAP9过表达质粒,慢病毒,稳定表达细胞株和siRNA均由吉满生物提供。 如想了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288
文章来源:课题组供稿
文献来源:https://onlinelibrary.wiley.com/doi/10.1002/advs.202207549