文献来源
2023年10月2日,中国科学院上海硅酸盐研究所朱钰方教授团队和澳大利亚昆士兰科技大学生物医学技术中心肖殷教授团队在Applied Materials Today上发表了“A coronavirus-mimic mesoporous silica nanosystem enables efficient targeted delivery of siRNA for anti-SARS-CoV-2”的研究论文。
考虑到目前对特异性抗新型冠状病毒SARS-CoV-2感染药物的迫切需求,该工作中团队设计制备了一种冠状病毒刺突S蛋白修饰的大孔径、高比表面积的树枝状介孔二氧化硅纳米颗粒,用于有效地、靶向地递送特异性的siRNA,实现了对SARS-CoV-2相关基因的高效沉默,也为临床治疗SARS-CoV-2感染提供了新的借鉴。
研究背景
病毒感染一直威胁着人类的生命健康,特别是由SARS-CoV-2感染引起新冠肺炎疾病。到目前为止,市面还没有针对SARS-CoV-2具有高特异性的药物。此外,滥用现有药物对抗SARS-CoV-2感染可能会对身体产生某些不良影响。因此,迫切需要开发新的安全、有效的抗这类冠状病毒的治疗方法。
RNA干扰介导的靶基因沉默技术被认为是一种在遗传水平上治疗各种疾病的强大手段,如针对癌症和病毒感染性疾病。作为一种RNA干扰工具,合成的siRNA可用于在细胞质中高效特异性地沉默病毒基因,以保护细胞基因组免受病毒遗传物质的侵袭。而且,siRNA的引入不会改变宿主细胞基因组,并且具有低细胞毒性,显示出巨大潜力。然而,siRNA的应用受到稳定性差、易被内源性核酸酶降解、穿细胞膜的能力低、靶向性差等固有限制。因此,将纳米递送技术运用于siRNA介导的抗SARS-CoV-2应用呈现出巨大的优势。
图1 方案如图
SARS-CoV-2 S蛋白修饰的树突状介孔二氧化硅纳米颗粒(DMSN)用于递送特异性siRNA治疗SARS-CoV-2感染
项目研究
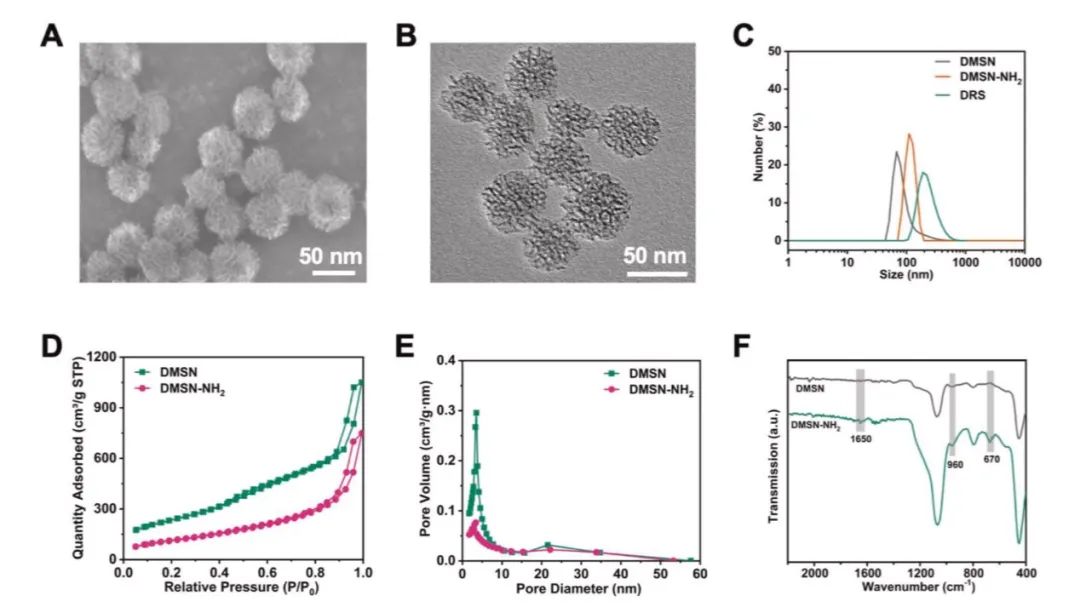
在该项目研究中,团队首先制备了大孔径、高比表面积的树枝状介孔二氧化硅纳米颗粒,进一步进行特定siRNA的负载和S蛋白的修饰,最终构建了抗SARS-CoV-2的纳米系统。
实验中发现,得益于大的介孔和高比表面积,该纳米系统显示出siRNA的高效负载,不仅可以提高siRNA的稳定性并保护其免受核酸酶降解,而且可以在生理环境中持续缓慢地释放siRNA。
图 2 DMSN和DMSN-NH2纳米粒子的合成与表征
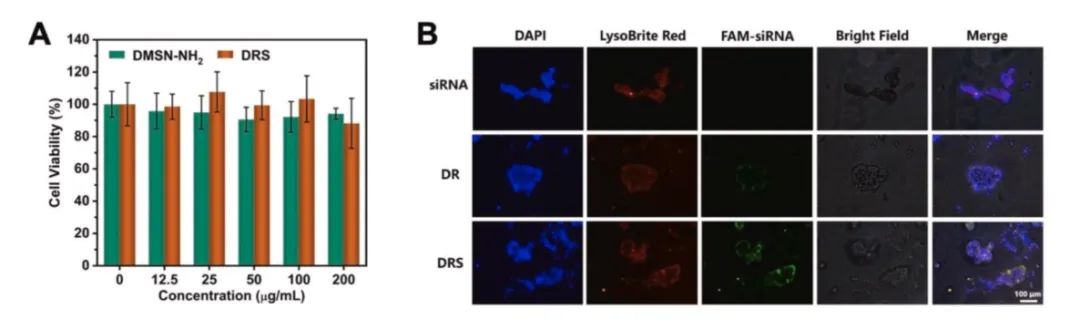
进一步地,细胞实验证明该纳米系统具有较高的生物相容性。而且,基于S蛋白和ACE2受体的特异性结合性质,该纳米系统能实现siRNA向ACE2过表达细胞的靶向递送,并促进其进入细胞。
图3 DRS纳米系统的体外细胞摄取和细胞毒性研究
最终,在基因沉默效率评估中发现,与游离的siRNA和没有S蛋白修饰的纳米系统相比,S蛋白修饰的纳米系统递送的siRNA对ACE2过表达靶细胞中SARS-CoV-2的RdRp基因的沉默效率最高,有利于抑制SARS-CoV-2在宿主细胞内的复制。
该研究由中国科学院上海硅酸盐研究所朱钰方教授团队和澳大利亚昆士兰科技大学生物医学技术中心肖殷教授团队合作完成。中国科学院上海硅酸盐研究所陈佳杰博士生为第一作者。朱钰方教授和肖殷教授为共同通讯作者。该工作得到上海市科学技术委员会项目资助。 吉满助力 本研究中所用的质粒载体lenti-CMV-MCS-3×Flag-PGK-Puro以及慢病毒包装、过表达稳定株(ACE2OE-293T)转染过程均由吉满生物完成。 了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288 文章来源:课题组供稿 文献原文:https://doi.org/10.1016/j.apmt.2023.101952 原文引用: “An ACE2-overexpressed human embryonic kidney 293T cell line(ACE2OE-293T)were obtained from Sino Biological Inc., China. In addition, the RdRp gene of the SARS-CoV-2 genome (MT039890) was stably transfected into the ACE2OE-293T cells by a lentivirus infection method (Genomeditech).”