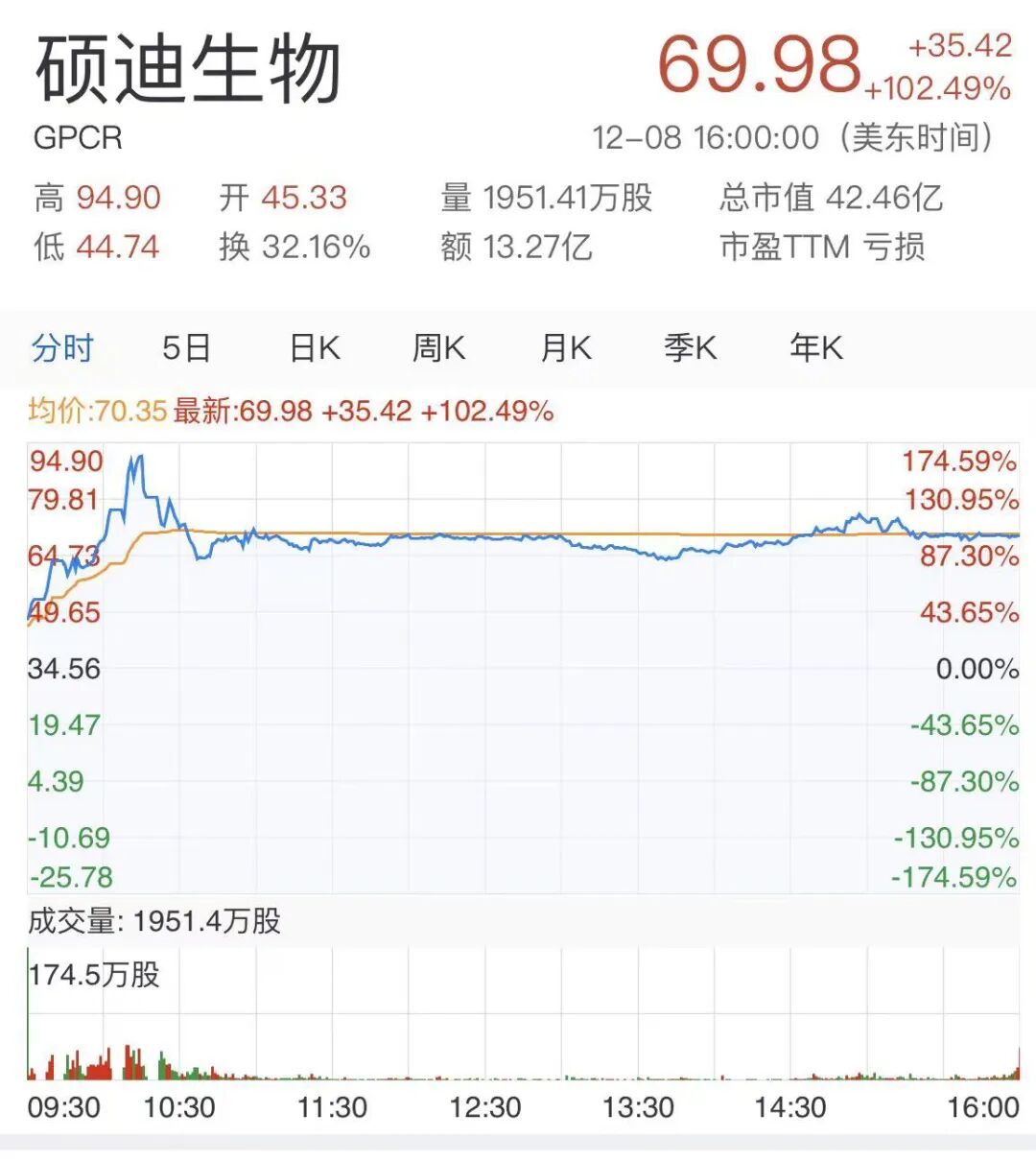
2025年12月8日,硕迪生物公布了其口服小分子GLP-1受体激动剂aleniglipron(GSBR-1290)在两项Ⅱb期临床试验(ACCESS与ACCESS II)中取得的积极36周顶线结果。点击了解GLP-1相关产品
受此消息影响,硕迪生物盘前大涨30%,开盘后一路走高,截至发稿涨幅已高达102%。
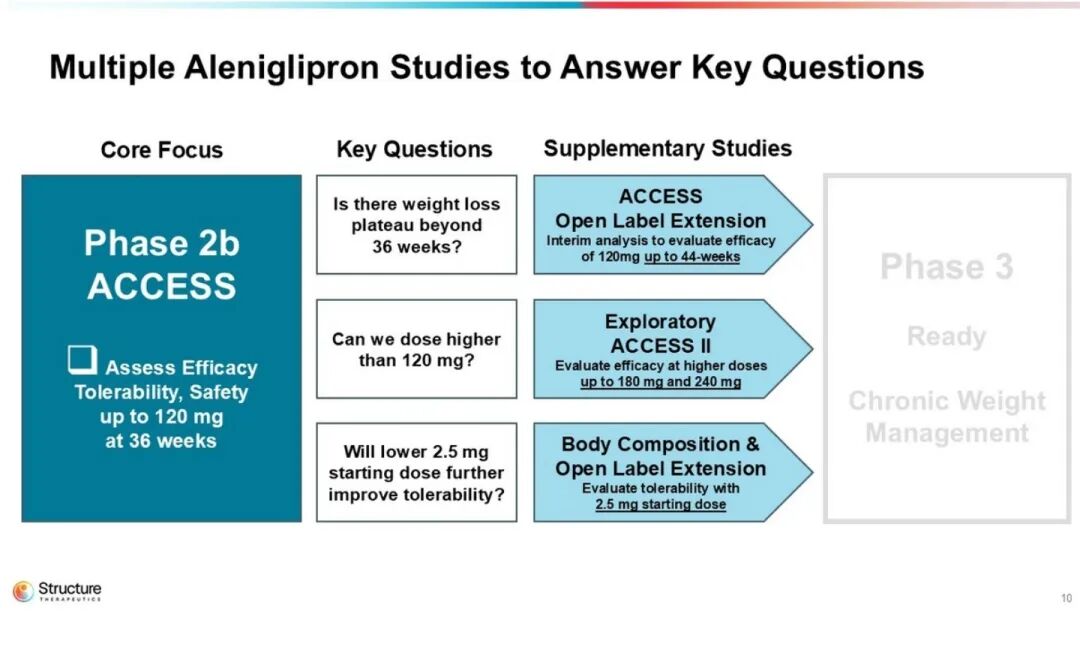
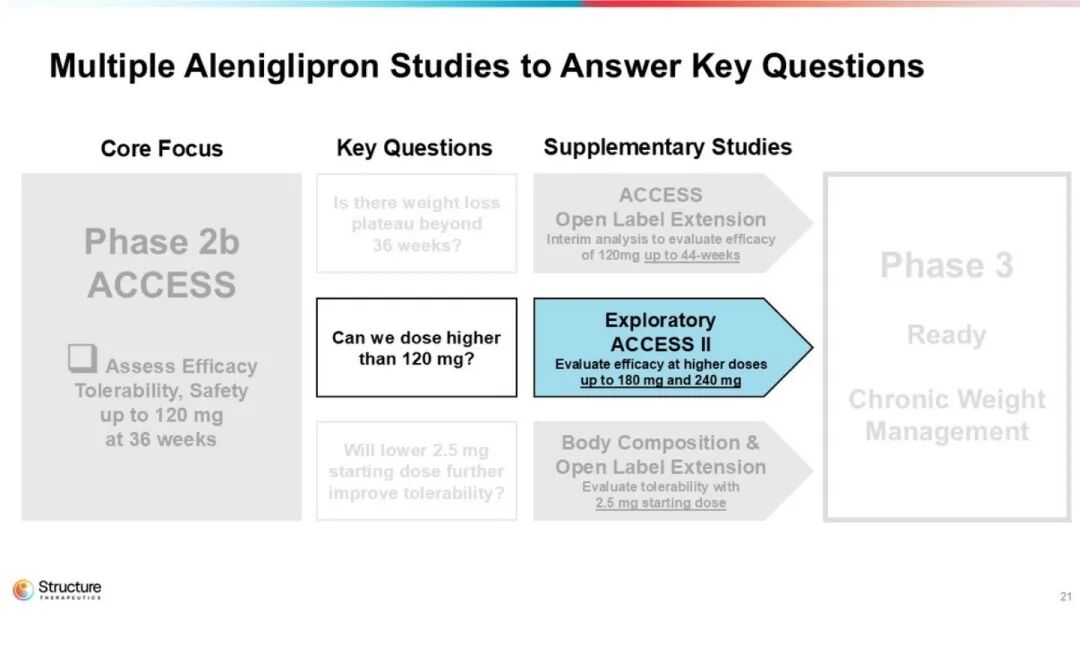
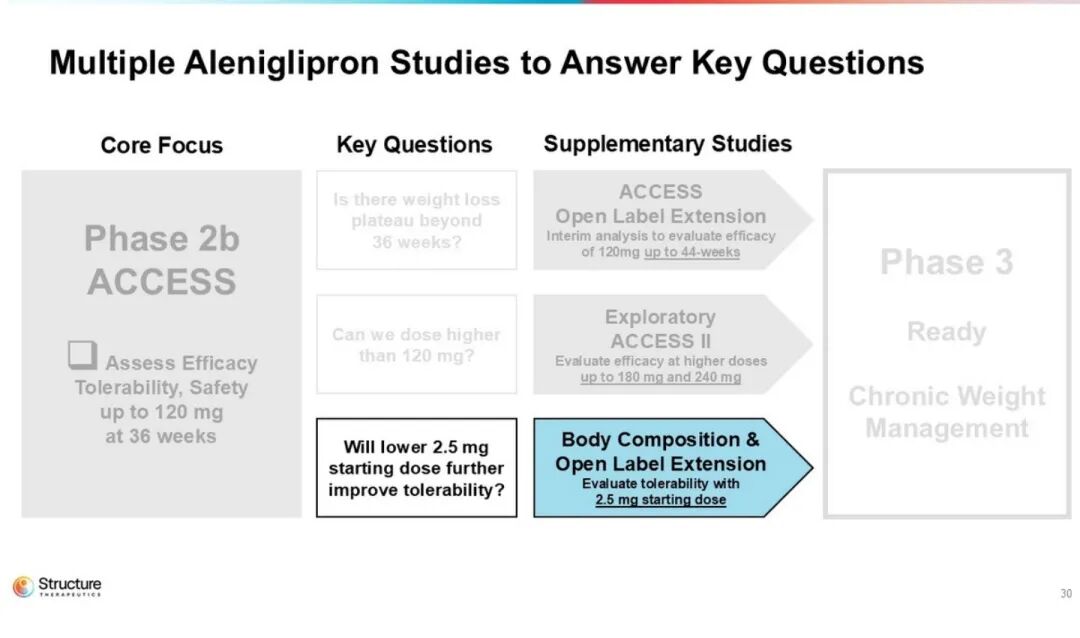
本研究共纳入300例受试者,采用“四周阶梯”低剂量起始给药策略,整体分为三部分:首先,在45、90、120 mg剂量组中评估36周减重效果;其次,探索更高剂量以进一步提升疗效;最后,考察从更低剂量开始滴定的给药方案,以改善耐受性。
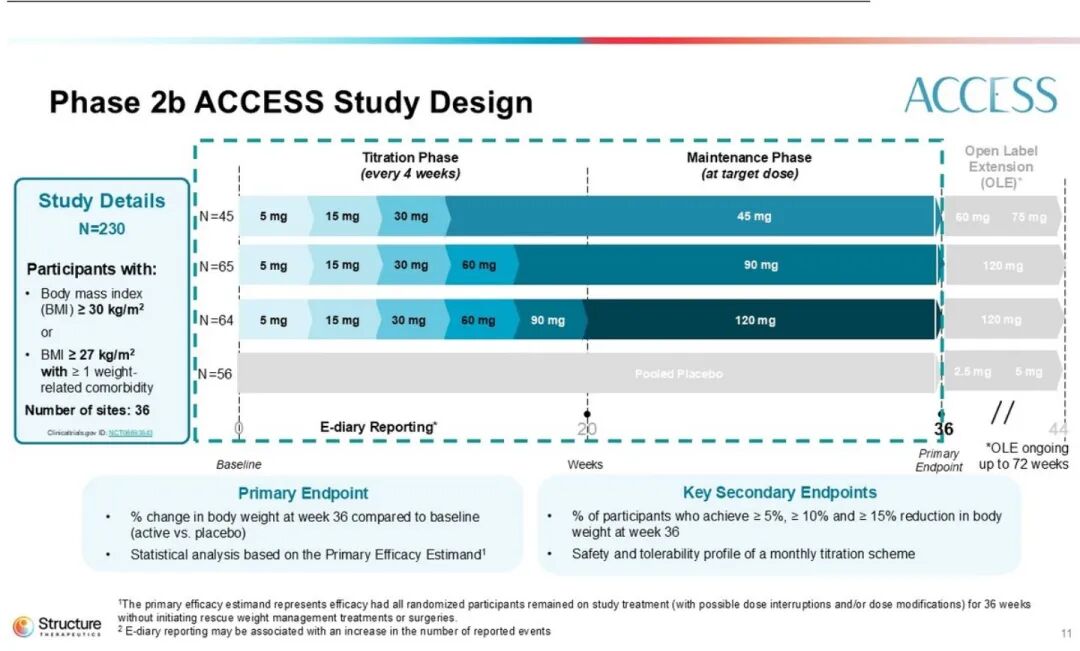
ACCESS研究为一项随机、双盲、安慰剂对照试验,共纳入230例受试者,设置45、90及120 mg三个剂量组。在完成36周双盲期治疗后,受试者可进入开放标签扩展阶段。
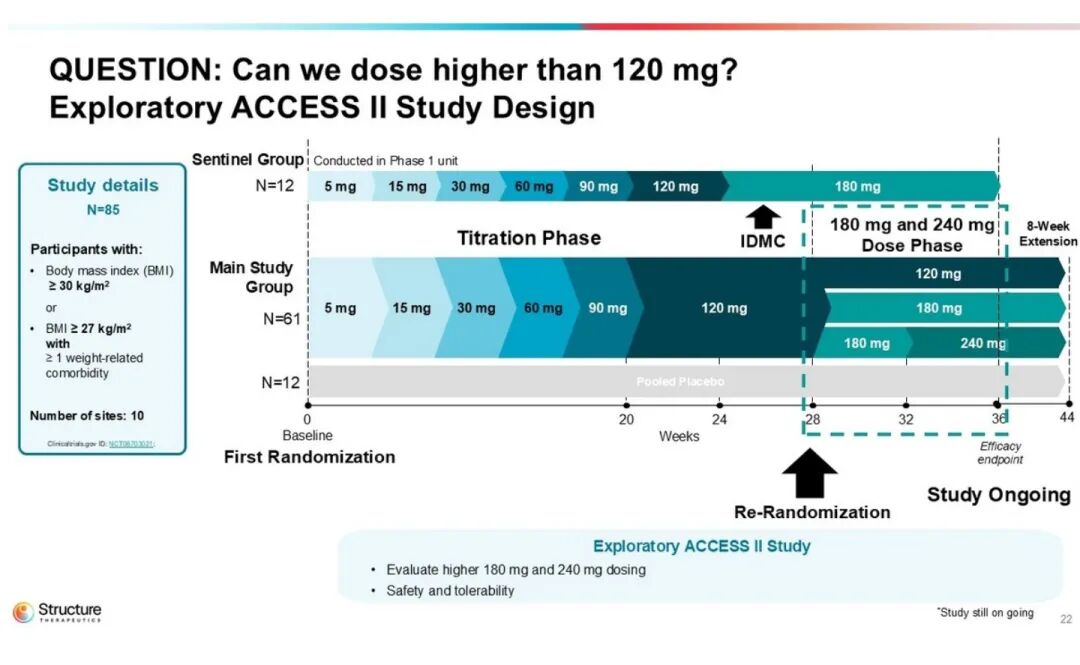
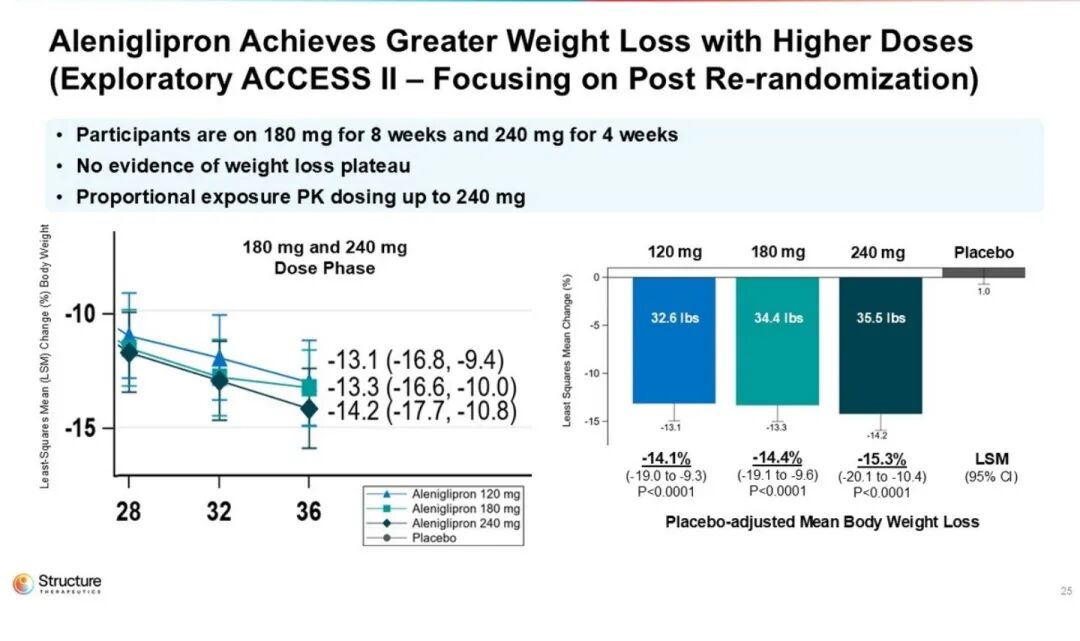
ACCESS II 研究n=85,聚焦更高剂量 180/240 mg,36 周核心数据后追加 8 周双盲随访,以进一步评估胃肠道耐受性 。
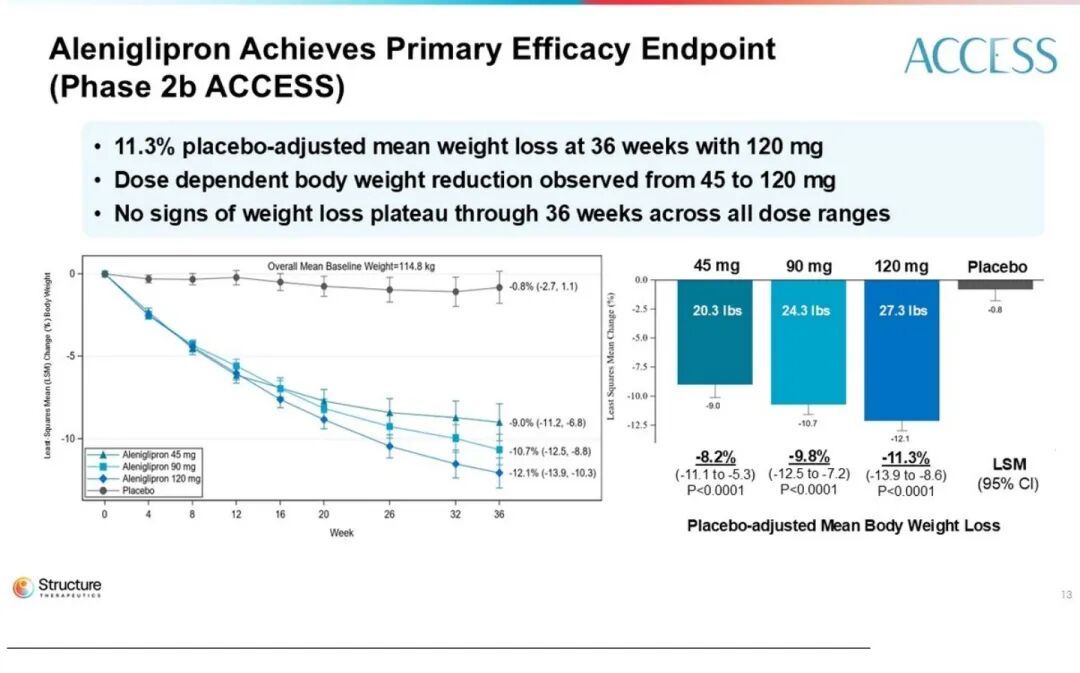
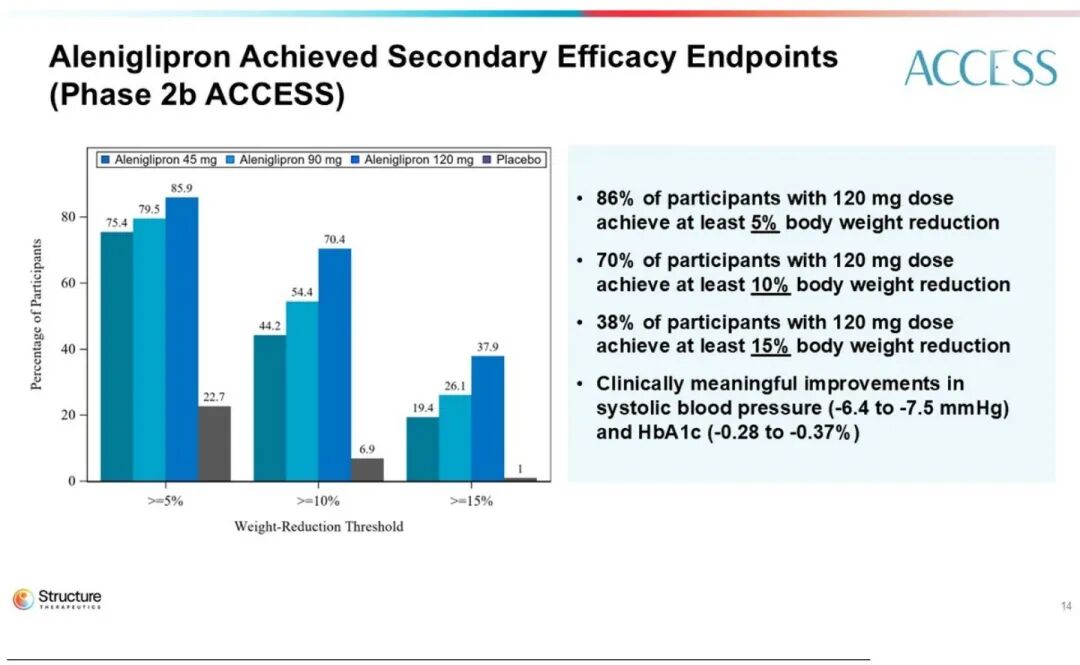
高剂量组(120 mg)在对照组校准后,平均减重达11.3%。次要终点显示:70%的患者减重超过10%,38%的患者减重超过15%。
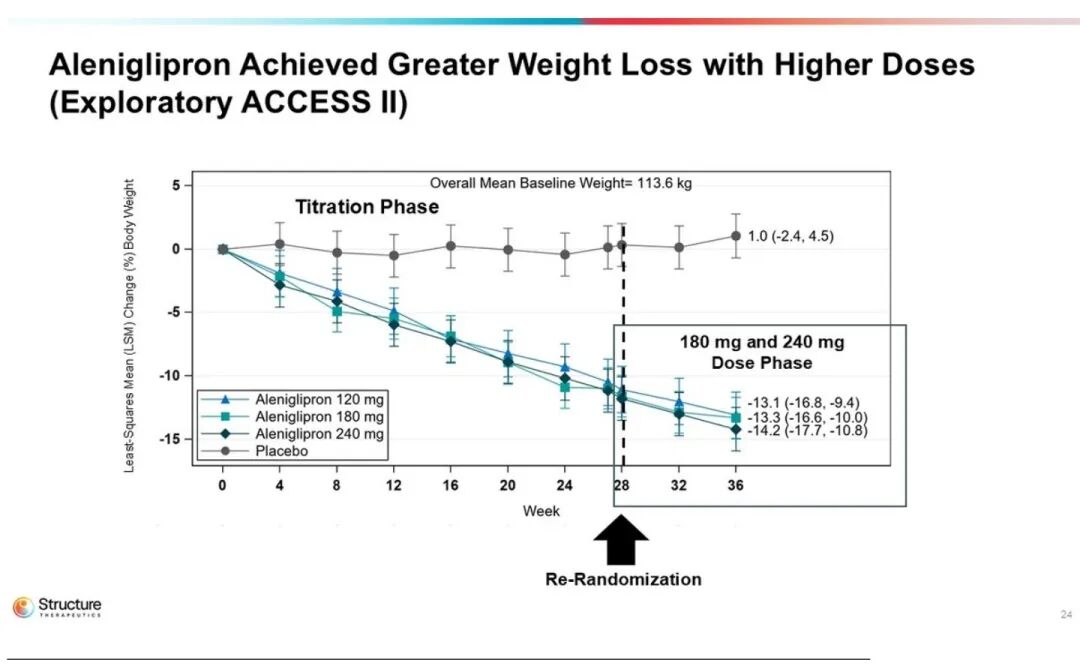
随着剂量提升,减重曲线逐渐平缓,尤其在120 mg时呈现出剂量平台效应,与更高剂量组的疗效趋于重叠。进一步的放大数据表明,在120–240 mg剂量范围内,患者平均体重较基线下降幅度为14.1%至15.3%。
安全性数据如下
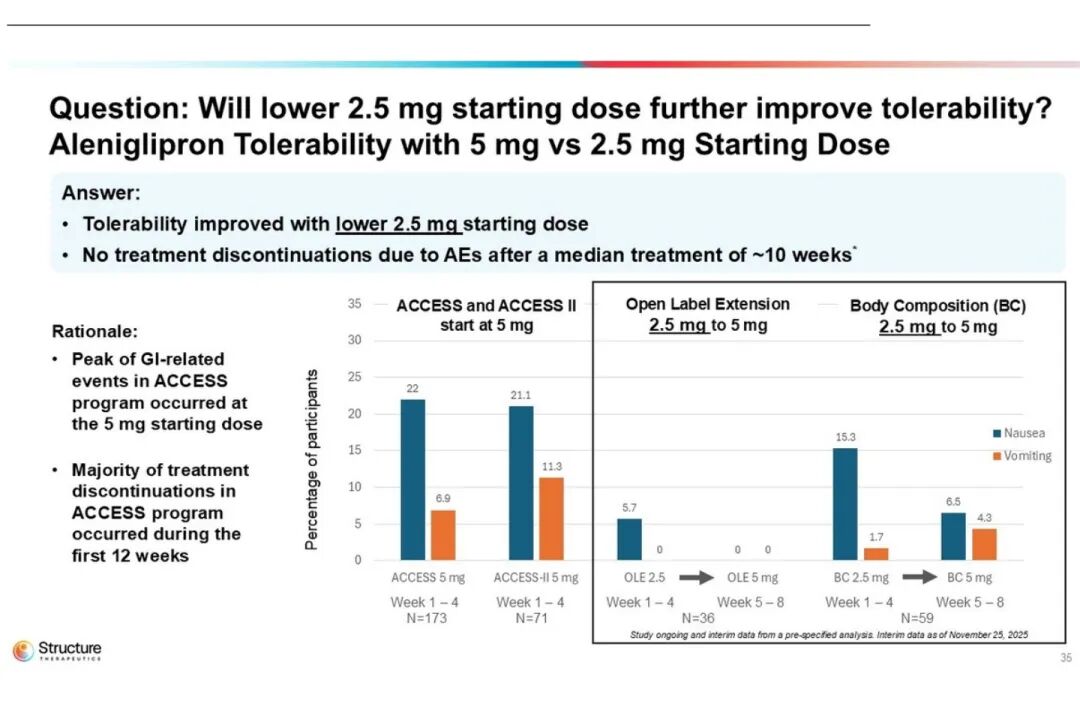
此外,硕迪生物也探索了以更低起始剂量(2.5 mg)给药以提升耐受性。
结果显示,与5 mg起始剂量相比,2.5 mg起始剂量的耐受性显著提高,且在10周治疗期间未发生任何因治疗相关不良事件导致的停药。
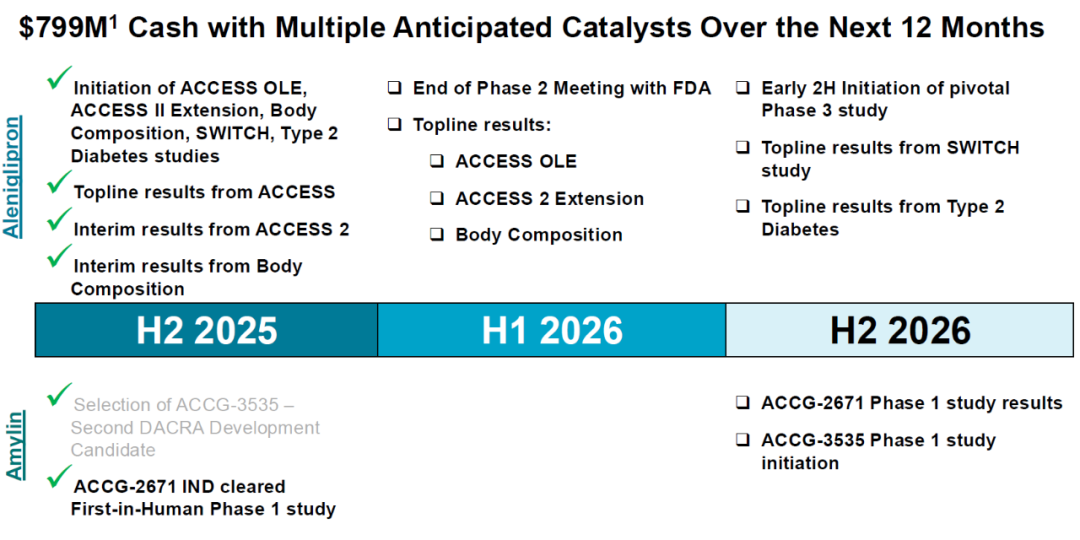
硕迪生物预计将于2026年下半年启动关键三期临床研究。
目前其现金 7.99 亿美元,可覆盖Ⅲ期启动费用 。
综合对比来看:
礼来口服orforglipron在36 mg剂量组36周时安慰剂调整后减重约11.5%,停药率介于10%至21%。
诺和诺德口服司美格鲁肽(Rybelsus)在糖尿病适应症中的最高批准剂量为14 mg,治疗68周减重约9.9%,因胃肠道不良事件导致的停药率为7%。
硕迪生物研发的aleniglipron在减重幅度、患者耐受性,以及基于小分子片剂的可扩展产能方面均表现出优势,被Leerink机构评为“潜在的同类最佳(best-in-class)疗法”。